Chapitres

Exercice 1 : La perfusion
Lors d'une perfusion, on introduit dans la veine au point B, un liquide de masse volumique p (rhô) de façon lente dans le système circulatoire du patient. La pression du sang dans la veine au point B est Psang = 1,06 x 10^5 Pa.
1. Donner l’expression de PB en fonction de Patm , ρ, g et h.
2. Sans calcul, déterminer la valeur minimale de la pression PB que doit posséder le liquide à perfuser pour introduire (de façon lente) le liquide dans une veine ?
3. Donner la relation entre Patm, Psang, ρ, g et h
4. En déduire l’expression de la hauteur minimale h du flacon pour que le liquide puisse être introduit ?
5. Calculer la hauteur minimale h à laquelle doit être placée la poche si le liquide à perfuser possède une masse volumique p (rhô)= 1100 S.I (unité du Système Internationale).
Données pour cet exercice :
- Patmosphérique = 1,013 .105 Pa ;
- g = 9,8N.kg
Voilà on nous en sommes :
2. Pour introduire de façon lente un liquide dans une artère il faut que la pression du liquide à l'extrémité d l'aiguille soit supérieure à la pression du sang. (Nous savons que nous n'avons en aucun cas répondu à la question mais il s'agit d'un début de résonnement)
5. Nous avons trouvés 1,72 x 10^5
Deuxième Exercice
1. Définir la tension artérielle notée TUn homme de 1,75 m se tient debout. Son cœur se situe à 1,30 m du sol. Sa tension artérielle au niveau de son cœur est Tc =13300 Pa
2. Calculer la tension artérielle Tp au niveau des pieds si la pression sanguine Pp au niveau des pieds est 128104 Pa
3. Calculer la pression sanguine Pc au niveau du cœur.
4. Montrer que la différence de tension artérielle entre ces deux niveaux est égale à la différence de pression du sang entre ces deux niveaux
5. En appliquant la relation fondamentale de la statique des fluides et l’énoncé de la question précédente, retrouver la valeur de la masse volumique ρsang du sang déterminée dans la question 1.a
6. Pourquoi un médecin préfère t-il faire allonger son patient pour prendre la tension artérielle ?
Voilà on nous en sommes :
1. La tension artérielle (notée T) est la diférence entre cette pression sanguine et la pression atmosphérique. Elle est définie par la relation T = psang - patm, exprimée en cmHg.
2. Nous pensons qu'il s'agit de : Tarterielle = Parterielle - Patm = Parterielle - p(rhô)sang x g x h = 128104 + p(rhô)sang x g x h = 14,2 kPa soit env. 14 kPa
5. msang = 1,72 x 10^5
6. En position allongée, la tension arterielle est sensiblement la même en tous les points du corps et est égale à Tcoeur. On dit qu'il se situe sur le même plan horizontal, et dans ce cas, la variation de la tension arterielle entre 2 points du corps est nulle.
Donc voilà notre raisonnement pour l'instant en espérant qu'un génie de la physique sera apte à nous aider.
Exercice 2 : La fabrication d'un ponton marin

Vous faites partie d'un laboratoire d'ingénierie qui doit étudier la conception d'un ponton. En marine, le ponton (ou embarcadère) permet l'embarquement ou le débarquement de passagers et l'amarrage des bateaux. L'image, ci-contre, montre un ponton en construction.
Cet exercice porte sur la corrosion de piliers métalliques partiellement immergés en eau de mer. Vous devez, pour cela, lire attentivement l'ensemble des documents proposés, répondre à des questions à choix multiples sur l'annexe à rendre avec la copie puis résoudre le problème posé à l'aide d'une rédaction d'au minimum 20 lignes.
Document 1
L'acier est un alliage métallique utilisé dans les domaines de la construction mécanique. L'acier est constitué d'au moins deux éléments, le fer, très majoritaire, et le carbone, dans des proportions comprises entre 0,02 % et 2 % en masse. C'est essentiellement la teneur en carbone qui confère à l'alliage les propriétés du métal qu'on appelle « acier ».
Pour l'acier, la corrosion se traduit par la formation de rouille. Ce produit composé d'oxydes plus ou moins hydratés ne se forme qu'en présence de dioxygène et d'eau à température ordinaire. Cette corrosion est dite aqueuse, et c'est la forme la plus fréquemment rencontrée en construction métallique.
La corrosion est un phénomène électrochimique : cela signifie qu'il se crée des piles à la surface de l'acier, dans lesquelles une des électrodes, l'anode, se consomme au bénéfice de l'autre, la cathode, qui reste intacte. L'électrolyte est constitué par l'eau, plus ou moins conductrice et oxygénée.
Les deux demi-équations mises en jeu dans le phénomène de corrosion sont :
½ O2 + 2 e- + H2O → 2 HO-
Fe2+ + 2 e- → Fe
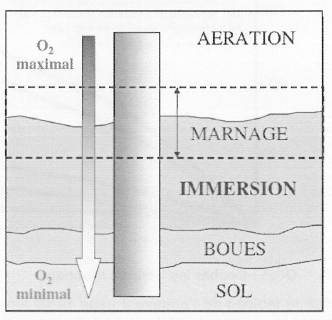
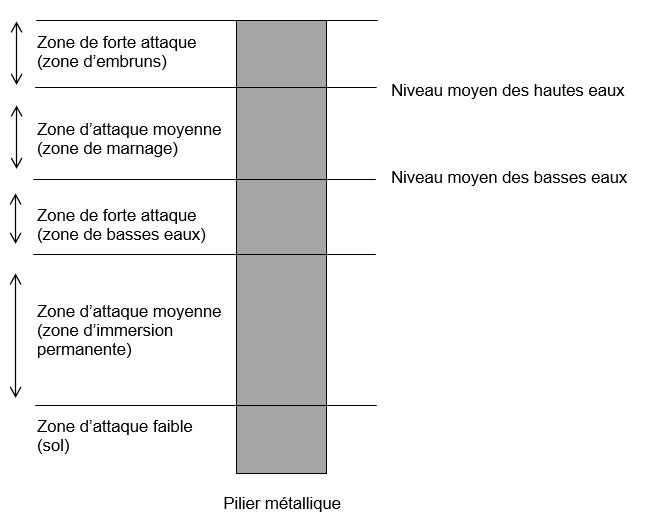

1. QCM: Cocher les bonnes réponses.
Sur le tableau de l’annexe 2 à rendre avec la copie, cocher les bonnes réponses en précisant à chaque fois le numéro du document utilisé pour répondre à la question. Chaque bonne réponse amène des points. Une mauvaise réponse ne conduit pas à un retrait de points.
2. Question de synthèse :
À partir des documents fournis et de vos connaissances personnelles, donner, en justifiant votre réponse, les caractéristique de la corrosion des piliers métalliques au bord de la mer et proposer ensuite des pistes pour augmenter la durée de vie du ponton. Prendre soin, pour cela, d’utiliser la totalité des documents proposés, d’apporter une solution au problème posé en veillant à structurer les informations recueillies, d’adopter un jugement critique argumenté et rédiger un document d’au minimum 20 lignes dans un français correct.
Pour chaque question, indiquer si la réponse est Oui ou Non et dans quel Document se trouve l'information.
1. La corrosion des piliers métalliques est la même sur toute leur hauteur.
2. La quantité de dioxygène est identique sur toute la hauteur du pilier métallique.
3. La corrosion est plus importante à la base du pilier métallique.
4. La température moyenne a une influence sur la perte d’épaisseur d’acier au cours du temps.
5. L’équation d’oxydoréduction associée à la corrosion humide peut être écrite : Fe(s) + H2O(l) → 2 HO-(aq) + Fe2+(aq)
6. Un pilier métallique perd 0,2 mm d’épaisseur au bout de 5 ans en présence d’une atmosphère humide et polluée.
Exercice 3 : La voiture plus propre
Au début du mois de juin 2019, le projet de loi « mobilités » a été présenté et discuté à l’Assemblée nationale. Son ambition est d’améliorer concrètement les déplacements au quotidien pour tous les citoyens français et dans tous les territoires.
Sachant que les transports représentent 30 % des émissions de gaz à effet de serre, ils constituent le premier secteur émetteur et leur impact environnemental est donc majeur. Pour répondre aux enjeux, l’un des trois piliers de ce projet de loi s’intitule « Engager la transition vers une mobilité plus propre ».
L’objectif de cet exercice est d’étudier deux solutions mises en œuvre aujourd’hui pour limiter l’impact écologique du transport routier.
Données
| Élément | H | O | C | N |
|---|---|---|---|---|
| Numéro atomique | 1 | 8 | 6 | 7 |
| Masse molaire atomique (en g.mol-1) | 1,0 | 16,0 | 12,0 | 14,0 |
| Configuration électronique | (1s)1 | (1s)2(2s)2(2p)4 | (1s)2(2s)2(2p)2 | (1s)2(2s)2(2p)3 |
| Électronégativité (échelle de Pauling) | 2,2 | 3,4 | 2,5 | 3,0 |
Masse volumique de l’éthanol : r(éthanol) = 789 g.L-1
Énergie molaire de liaison en phase gazeuse (en kJ.mol-1) :
| E(H – H) | E(C – H) | E(C – C) | E(C – O) | E(O – H) | E(O = O) | E(C = O) (dans CO2) |
|---|---|---|---|---|---|---|
| 436 | 415 | 346 | 358 | 463 | 497 | 804 |
1. L’évolution du parc automobile français
Le projet de « loi mobilités » fixe la fin des moteurs à combustion en 2040. Cet objectif sans précédent annonce de profonds changements pour les constructeurs automobiles. Le document suivant retrace l’évolution de la répartition des immatriculations des véhicules légers vendus en France entre l’année 2015 et le milieu de l’année 2019.
| 2015 | 2016 | 2017 | 2018 | 2019 | |
|---|---|---|---|---|---|
| Essence | 38,56 % | 43,82 % | 47,58 % | 54,67 % | 58,82 % |
| Diesel | 57,22 % | 52,12 % | 47,29 % | 38,87 % | 34,26 % |
| Hybride (électrique + essence/diesel) | 3,21 % | 2,90 % | 3,86 % | 4,89 % | 4,96 % |
| Électrique | 0,90 % | 1,08 % | 1,18 % | 1,43 % | 1,80 % |
| Autre | 0,11 % | 0,08 % | 0,09 % | 0,14 % | 0,16 % |
1.1. Définir une réaction de combustion.
1.2. En exploitant les données du tableau précédent, expliquer pourquoi les constructeurs automobiles sont encore aujourd’hui dans l’obligation de développer des moyens pour limiter les polluants rejetés par les véhicules fonctionnant à partir d’une réaction de combustion.
2. Cas des moteurs fonctionnant à l’essence : le bioéthanol.
Face à la hausse des coûts des produits pétroliers et pour limiter l’impact écologique, l’usage de carburants obtenus à partir de végétaux cultivés ou de résidus de cultures vivrières(1) se développe. Ces carburants sont appelés « biocarburants » ou encore « agrocarburants ». Pour les véhicules à essence, il est possible d’ajouter de l’éthanol (« bioéthanol ») à l’essence usuelle ; depuis l’année 2010, les véhicules neufs peuvent rouler avec un carburant contenant jusqu’à 10 % d’éthanol et nommé 95-E10.
(1) cultures vivrières : se dit des cultures dont les produits sont destinés à l'alimentation humaine
2.1. Obtention du « bioéthanol »
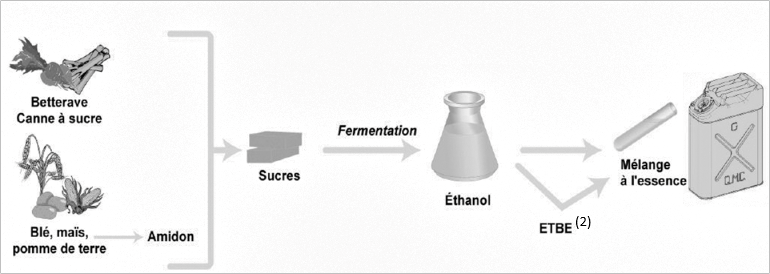
(2) ETBE : additif pour carburant
Les végétaux contiennent des sucres (comme le saccharose). L’hydrolyse du saccharose C12H22O11, réaction du saccharose avec de l’eau, donne du glucose et du fructose, composés chimiques de même formule brute C6H12O6. Ensuite, la fermentation du glucose permet d’obtenir de l’éthanol et du dioxyde de carbone.
2.1.1. Écrire l’équation de la réaction modélisant l’hydrolyse du saccharose et celle modélisant la fermentation du glucose.
2.1.2. Pour extraire l’éthanol du moût de fermentation, une distillation est nécessaire.
2.2. Énergie molaire de la réaction de combustion de l’éthanol
La combustion de l’éthanol est modélisée par la réaction d’équation suivante :
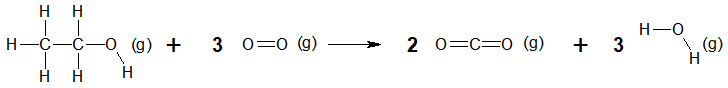
2.2.1. Exprimer, puis calculer l’énergie molaire de la réaction de combustion de l’éthanol en fonction des énergies molaires de liaison. Interpréter le signe de cette valeur.
2.2.2. Un litre d’essence ne contenant pas de bioéthanol libère une énergie équivalente à 35,5 MJ. Indiquer si l’ajout d’éthanol modifie le pouvoir calorifique du carburant.
Le candidat est invité à prendre des initiatives et à présenter la démarche suivie, même si elle n’a pas abouti. La démarche est évaluée et nécessite d’être correctement présentée.
- Cas des moteurs fonctionnant au diesel : les technologies DOC et SCR
En 2014, la norme Euro 6 (norme européenne) est entrée en vigueur. Sixième du nom, elle fixe d'une façon très précise le niveau de rejet de quatre polluants présents dans les gaz d’échappement des véhicules immatriculés dans les pays d'Europe de l'Ouest :
- NOx : les oxydes d’azote NO2 et NO ;
- HC : les hydrocarbures n’ayant pas été consommés dans la chambre de combustion ;
- CO : le monoxyde de carbone ;
- PM : les particules fines.
Pour répondre aux dernières exigences européennes, les constructeurs doivent équiper leurs véhicules de dispositifs pour traiter ces polluants avant qu’ils ne s’échappent dans l’atmosphère. Dans la suite du sujet, on s’intéressera à deux d’entre eux : le DOC (Diesel Oxydation Catalyst) et le SCR (Selective Catalyst Reduction).
Descriptif de traitement des gaz d’échappement :
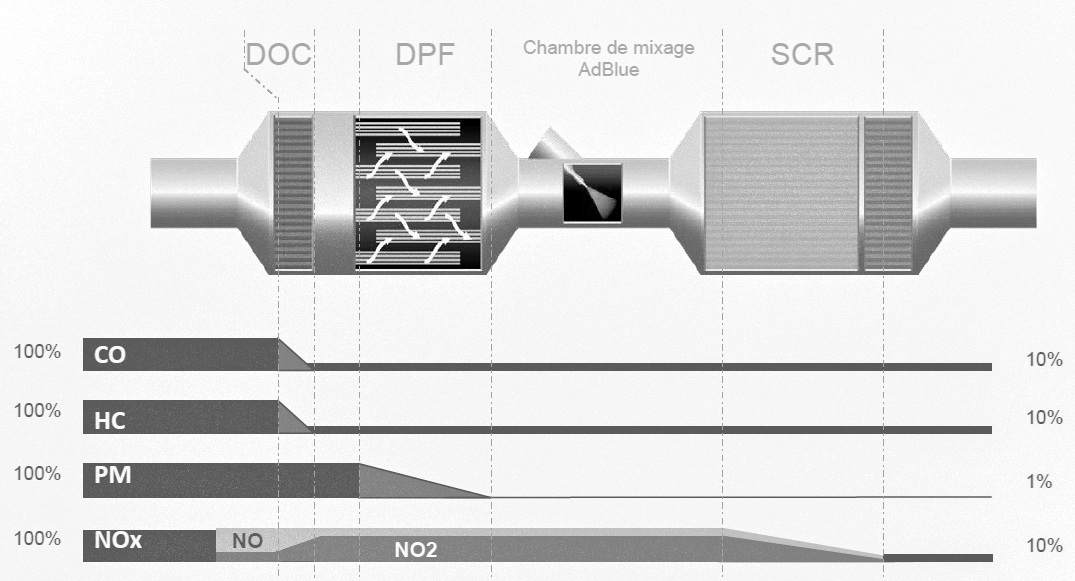
3.1. Le dispositif DOC
Les gaz d’échappement traversent une surface imprégnée de métaux précieux favorisant leur réaction à haute température avec le dioxygène de l’air.
D’après le document constructeur décrivant le traitement des gaz d’échappement, donner le polluant sur lequel le DOC est inactif.
3.2. Le dispositif SCR
Le principe de ce dispositif repose sur l’usage d’un additif de type Adblue®. L’additif est une solution incolore et biodégradable contenant 32,5 % d’urée, de formule brute CON2H4, et 67,5 % d’eau.
Le schéma de Lewis de la molécule d’urée est représenté ci-dessous:
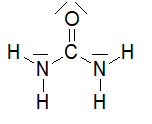
3.2.1. Dénombrer le nombre d’électrons de valence des atomes de carbone, d’oxygène, d’azote et d’hydrogène et justifier succinctement le schéma de Lewis de la molécule d’urée.
3.2.3. Choisir parmi les formes géométriques suivantes -pyramidale, tétraédrique ou triangulaire- celle formée par les trois atomes autour de l’atome de carbone central. Justifier.

Exercice 4 : Des moustiques résistants aux insecticides
De 1968 à 2002, la population de moustiques Culex pipiens a été contrôlée dans le sud de la France par l’épandage d’insecticides sur les étendues d’eau dans lesquelles se développent leurs larves.
On s’intéresse à la résistance développée par certains moustiques à ces insecticides dans la région de Montpellier.
Document 1 : résistance de Culex pipiens aux insecticides.
Des insecticides organophosphorés ont été utilisés pour lutter contre le moustique Culex pipiens. Certains moustiques y sont devenus résistants. L’étude du génome du moustique a montré que le moustique possédait un gène codant une molécule (enzyme), sous deux allèles :
- L’allèle R (résistance) conférant la capacité de résister aux insecticides ;
- L'allèle S (sensible).
On observe que la quantité de cette enzyme produite dépend du génotype du moustique. On constate que la quantité de celle-ci est ainsi 500 fois plus importante chez un moustique résistant que chez un moustique sensible.
Document 2 : action de l’enzyme sur un insecticide, le parathion.
Le parathion est, comme tous les insecticides organophosphorés, une molécule qui altère le fonctionnement du système nerveux du moustique entraînant sa mort. Pour qu’il soit efficace, il doit pénétrer dans l’organisme de l’insecte et atteindre son système nerveux.
Document 3 : échantillonnage d’une population de moustiques dans la région de Montpellier
La carte ci-dessous définit les différentes zones exposées ou non aux insecticides organophosphorés.
La zone 1, située au nord, n’a jamais été traitée avec des insecticides organophosphorés.
La zone 2, située au sud, a été traitée avec des insecticides organophosphorés depuis 1968. À cette époque, ces insecticides étaient très efficaces dans cette zone et tuaient la majorité des moustiques.
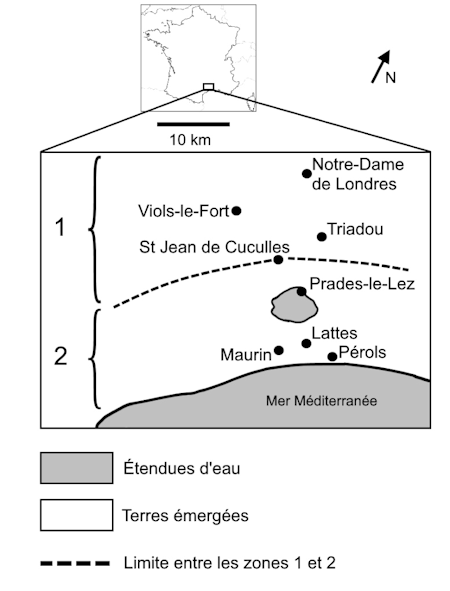
En 1980, un échantillonnage a été réalisé dans une population de moustiques située à Maurin (zone 2) afin d’étudier la structure génétique de cette population.
Les résultats de cette étude sont résumés dans le tableau ci-dessous.
| Génotypes concernant le gène de résistance à l’insecticide (doc. 1) | R//R | R//S | S//S | Total |
|---|---|---|---|---|
| Résistance à l’insecticide | oui | oui | non | |
| Nombre de moustiques | 90 | 284 | 70 | 444 |
| Fréquence génotypique observée | 0,20 | 0,64 | 0,16 | 1 |
Questions :
1- À partir des documents 1 et 2 et de vos connaissances, expliquer l’acquisition de la résistance au parathion de certains moustiques.
2- À partir du document 3, vérifier que la structure génétique de la population n’est pas à l’équilibre de Hardy-Weinberg. Pour ce faire, on comparera les fréquences génotypiques observées dans la population de moustique aux fréquences génotypiques que vous calculerez selon le modèle de Hardy-Weinberg.
Rappel du modèle de Hardy-Weinberg :
Soient A1 et A2 deux allèles d'un même gène, avec p la fréquence de l’allèle A1 et q la fréquence de l’allèle A2 et p + q =1, les fréquences génotypiques sont :
p2 = fréquence du génotype A1//A1
2pq = fréquence du génotype A1//A2
q2 = fréquence du génotype A2//A2
3- Expliquer les raisons pour lesquelles la structure génétique de la population n’est pas à l’équilibre de Hardy-Weinberg.

Exercice 5 : La résistance d'une bobine
Un étudiant, curieux, veut vérifier la valeur de la résistance r d’une bobine réelle d’inductance 250 mH, modélisée sous forme d’un dipôle (r , L) en série. La tension en fonction du temps dans le cas général d’un courant électrique d'intensité i(t) aux bornes d’une telle bobine est donnée par la relation :
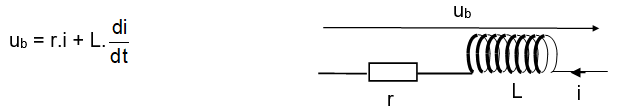
Il dispose de tout le matériel souhaitable et procède à plusieurs essais.
A – En régime permanent
Pour mesurer la valeur de r, l’étudiant réalise un circuit comportant un générateur de tension continue de valeur E = 6,0 V de résistance interne négligeable, un ampèremètre numérique, un voltmètre numérique, des fils de connexion et la bobine à étudier.
1. Compléter le schéma du circuit en indiquant les positions de l’ampèremètre et du voltmètre (annexe à rendre avec la copie). Faire figurer la tension Ug = E (tension aux bornes du générateur) ainsi que la tension Ub= (tension aux bornes de la bobine). On négligera la tension aux bornes de l’ampèremètre.
2. Les mesures des appareils donnent Ub = 5,95 V et Ib = 410 mA. En déduire la valeur r1 de la résistance de la bobine dans ce cas particulier. Justifiez votre démarche.
B – En régime transitoire
L’étudiant modifie le montage précédent auquel il ajoute une résistance R’ = 10,0 W en série.
Il remplace les appareils de mesure par un système d’acquisition informatisé qui lui donne les variations de i(t) obtenues à la fermeture de l’interrupteur. La tension du générateur reste fixe et égale à 6,00 V.
1. Quel est alors le phénomène observé dans le circuit ?
2. Sur le schéma du circuit modifié (annexe à rendre avec la copie), indiquer comment brancher le système d’acquisition (voie d’entrée et voie de référence) afin d’obtenir une tension proportionnelle à l’intensité du courant dans le circuit. Justifier votre réponse.
3. Déterminer la valeur de la constante de temps t à partir du document obtenu par le système d’acquisition. Détailler clairement la méthode utilisée sur le graphe donné en annexe à rendre avec la copie.
4. 4.1. La valeur de t de ce circuit est égale au rapport L / R où R représente la résistance électrique totale du circuit. Donner l’expression littérale de τ en fonction des paramètres du circuit et vérifier par une analyse dimensionnelle que τ est homogène à un temps.
4.2. La bobine ayant une inductance L = 250 mH, déduire la valeur r2 de sa résistance.
5. On considère que l’intensité i(t) atteint la valeur limite I∞ = 240 mA au bout d’une durée
5 fois supérieure à τ.
5.1. Quel est alors le régime de fonctionnement de la bobine ?
5.2. Exprimer r, résistance de la bobine en fonction de E, I∞ et R’. Calculer sa valeur r3.
6. Les trois valeurs r obtenues dans les parties A et B sont-elles cohérentes entre elles ?

C – En régime oscillatoire
Cette bobine est branchée aux bornes d’un condensateur de capacité C = 4 µF, préalablement chargé par un circuit annexe non représenté, selon le schéma ci-dessous :
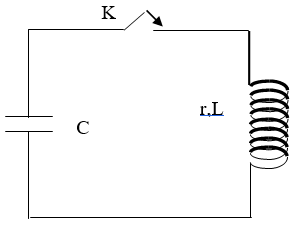
1. 1.1. Rappeler l’expression littérale de la période propre T0 d’un oscillateur LC.
1.2. Calculer la valeur de cette période T0.
2. 2.1. On branche un oscilloscope aux bornes du condensateur et on observe sur l’écran des oscillations pseudo-périodiques de pseudo-période T.
Interpréter l’amortissement des oscillations.
2.2. On constate, avec une base de temps de 2 millisecondes par division, que 2 pseudo-périodes occupent entre 6,2 et 6,4 divisions.
Donner un encadrement de la pseudo-période T ainsi mesurée.
2.3. Comparer ce résultat à T0.















Si vous désirez une aide personnalisée, contactez dès maintenant l’un de nos professeurs !