Chapitres

Présentation
Les alcanes sont des hydrocarbures saturés. C’est-à-dire qu'ils ne sont constitués que d'atomes de carbone (C) et d'hydrogène (H). Les alcanes se différencient des hydrocarbures insaturés par le fait que les atomes ne sont liés que par des liaisons simples, ce qui donne un nombre maximal d'atomes d'hydrogène (d'où le nom de "saturé"). Ils possèdent donc une formule brute de la forme CnH2n+2 où n est un entier naturel.
Rappels sur le carbone

Le carbone est principalement présent à l'état naturel sous deux formes allotropiques : le graphite et le diamant.
L'allotropie est la faculté de certains corps simples d'exister sous plusieurs formes cristallines ou moléculaires différentes.
Une forme allotropique peuvent avoir des propriétés physique, comme la couleur et la dureté, et une réactivité chimique différentes même si elles sont composées d'atomes identique
Les transformations d'une forme allotropique à l'autre peuvent être induites par des changements de pression et de température ou même par une réaction chimique. Certaines formes ne sont stables que sous certaines conditions définies de température et de pression
A pression et température ambiantes, le carbone se trouve sous sa forme de graphie à l'état naturel.
Il est apparu sur Terre dès la création de cette dernière comme en témoigne sa présence dans de nombreux sédiments (pétrole par exemple).
On peut pour finir le trouver sous d'autres formes comme :
- Charbon,
- Pétrole,
- Sédiments.
Le dioxyde de carbone, de formule , est présent quant à lui dans l'atmosphère sous forme de gaz et dans les eaux océaniques et continentales, sous forme de gaz dissout.
Les propriétés chimiques du carbone
Le carbone est un élément non soluble dans l'eau ainsi que dans aucun solvant organique.
Quand il est fortement chauffé, il s'oxyde pour former du monoxyde de carbone et du dioxyde de carbone.
Lié à l'hydrogène, le carbone est source de vie. Cette liaison apparaît dans chaque être vivant organique de la planète.
Le carbone compte 15 isotopes connus à ce jour. Leur nombre de masse s'étend de 8 à 22.
Le radioisotope le plus stable est la carbone 14, présent à l'état naturel avec une demi-vie d'environ 5000 ans.
Des isotopes sont des atomes qui possèdent le même nombre de protons mais un nombre différent de neutrons
Nomenclature

Les premiers sont :
- Le méthane CH4
- L'éthane C2H6
- Le propane C3H8
- Le butane C4H10
- Le pentane C5H12
- L'hexane C6H14
- L'heptane C7H16
- L'octane C8H18
- Le nonane C9H20
- Le décane C10H22
D'une manière synthétique, la nomenclature utilise le nom de l'alcane que constitue la chaîne carbonée et lui ajoute un suffixe qui traduit la fonction organique portée par la molécule.
Afin de garantir la bonne compréhension des explications qui suivront, on rappelle ici les dénominations des alcanes ainsi que vus en seconde :
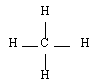 Méthane | 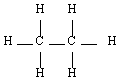 Ethane | 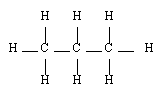 Propane |
|---|---|---|
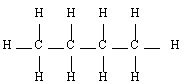 Butane | 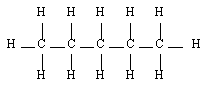 Pentane | 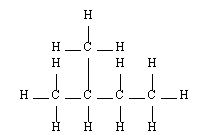 2-méthyl-butane |
Remarque : La nomenclature de l'alcane est utile pour la nomenclature des alcools
En effet, lorsque l'alcool est la fonction principale de la molécule que l'on cherche à nommer, il suffit alors de remplacer la voyelle terminale « e » de l'alcane correspondant à l'alcool que l'on cherche à nommer par le suffixe -ol. Il est ensuite nécessaire d'indiquer le numéro de l'atome de carbone où le groupe hydroxyle est fixé. Même si cette précision n'est pas toujours nécessaire, il est alors possible d'omettre cette précision pour une lecture plus digeste.
Si la fonction alcool n'est pas la fonction principale de la molécule, il faut alors ajouter le préfixe hydroxy- précédé du numéro de l'atome de carbone où le groupe est fixé.
Ensuite, pour nommer la base conjuguée de l'alcool, comme l'ion alcoolate, il suffit simplement de remplacer la voyelle terminale « e » par le suffixe -olate. Veillez à ne pas confondre avec le suffixe -oate qui est plutôt caractéristique du carboxylate, correspondant alors base conjuguée de l'acide carboxylique.
Cela est vrai car les alcools sont identifiables grâce à la fonction organique alcool qui consiste en un groupe -OH lié à l'un des carbones de la chaîne carbonée d'un alcane. En réalité, il y a trois classes d'alcools. On les distingue en fonction du nombre de groupes alkyles auxquels il est lié.
Prêt pour un cour de physique chimie ?
Réactions chimiques des alcanes

Les alcanes existent en grande quantité sous forme de gisements naturels de gaz ou de pétrole. L'origine de ces gisements est attribuée à la fermentation de la cellulose des végétaux des temps préhistoriques.
Le gaz naturel est essentiellement constitué de méthane et les pétroles contiennent un mélange d'hydrocarbures (dont des alcanes allant de C1H4 à C40H82).
Le méthane, l'éthane, le propane et le butane sont des gaz à température ambiante.
À partir de C5, on rencontre des liquides et à partir de C17 des solides.
Les alcanes liquides ou solides ont une densité assez faible (environ 0,7). Comme tous les hydrocarbures, ils sont insolubles dans l'eau ; par contre, ils sont miscibles avec la plupart des liquides organiques et sont eux-mêmes des solvants pour de nombreux composés organiques.
D'une façon générale, les alcanes sont assez peu réactifs, autrement dit stables. Ceci s'explique par le fait que les liaisons C-C et C-H sont assez fortes :
- C-C = 82,6 kcal/mol
- C-H = 100 kcal/mol
- (1 cal = 4,18 J)
Les alcanes peuvent réagir dans plusieurs réactions :
- Réaction de combustion : on brise la liaison C-C (le squelette de la molécule). Il en existe deux types :
- la complète qui produit du dioxyde de carbone et de l'eau
- l'incomplète qui produit du carbone (solide) et de l'eau
- Réaction de substitution : on brise la liaison C-H (on substitue H par un autre élément)
- Exemple: chloration du méthane
- (formation de monochlorométhane et de chlorure d'hydrogène gazeux)
- (formation de dichlorométhane et de chlorure d'hydrogène gazeux)
- (formation de trichlorométhane (chloroforme) et de chlorure d'hydrogène gazeux)
- (formation de tetrachlorométhane et de chlorure d'hydrogène gazeux)
- Exemple: chloration du méthane
- Réaction de déshydrogénisation: on créé une double liaison entre 2 carbones ( C=C ) de la chaînes en brisant la liaison de 2 H. Le produit resultant est un alcène.
La réaction de combustion des alcanes n'a pas un grand intérêt au niveau chimique car la molécule est complètement détruite. Par contre cette combustion a un grand intérêt pratique puisque les alcanes peuvent être utilisés comme carburant ou combustible du fait que cette réaction est très exothermique (libération de chaleur).
La combustion des alcanes
Un petit rappel sur les réactions de combustion qui posent parfois des problèmes (surtout au niveau de l'équilibrage des réactions)
Une réaction de combustion classique (du moins au niveau collège/lycée) consiste à "brûler" un composé organique (de formule générale CxHyOz) par de l'oxygène pour donner, dans le cas d'une combustion complète (ce qui est le cas dans tous les énoncés d'exercices sauf indication contraire), uniquement de l'eau H2O et du dioxyde de carbone CO2.
Équilibrer une équation de combustion
Reste maintenant à équilibrer l'équation (c'est à dire à trouver les coefficients stoechiométriques des réactifs et des produits). On cherche ainsi à écrire que ce qui est à gauche de la flèche de réaction est égal à ce qui est à droite (principe de conservation de la matière). Dans l'ordre, on équilibre d'abord les atomes de carbone, puis les atomes d'hydrogène et enfin les atomes d'oxygène (cette méthodologie est générale pour équilibrer n'importe quelle réaction et elle évite les erreurs lors de réactions plus compliquées à équilibrer)
Essayez de faire attention à ne pas tourner en rond lorsque vous mettez des indices et veillez aussi à ce que ces indices soit les plus petits entiers possibles !
Le cas du propane
Le propane à pour formule brute C3H8. L'équation de combustion s'écrit donc 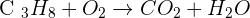
Pour équilibrer l'équation, il faut :
- 3 atomes de carbone à gauche et 1 à droite. Il faut donc multiplier par 3 le terme C02 à droite:
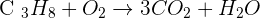
- 8 atomes d'hydrogène à gauche et 2 à droite. Il faut donc multiplier par 4 le terme H2O à droite:
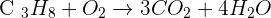
- 2 atomes d'oxygène à gauche et 3*2 + 4*1=10 à droite. Il faut donc multiplier par 5 le terme O2 à gauche:

- Les coefficients trouvés sont les plus petits entiers possibles.
L'équation de la réaction de combustion est donc: 
Émission de gaz pendant une combustion : un danger silencieux

Tous les ans, en hiver, des dizaines de personnes s'intoxiquent en utilisant un appareil de chauffage. Quel est le gaz responsable de cette intoxication ? Comment est-il produit ?
Réponse : lors d'une combustion incomplète, un gaz très toxique, le monoxyde de carbone, est produit. Dans quelles conditions ce gaz est-il produit ? Quels sont les autres dangers des combustions domestiques ?
Le monoxyde de carbone : l'ennemi inodore et incolore
La combustion des hydrocarbures produit du dioxyde de carbone. Quand le dioxygène est en quantité suffisante, la combustion est complète mais s'il n'y a pas assez de dioxygène, la combustion est incomplète et du monoxyde de carbone est produit. C'est un gaz incolore, inodore et toxique. Il empêche le dioxygène de circuler dans le sang et provoque l'asphyxie de l'organisme qui peut conduire à la mort. Les symptômes d'une intoxication peuvent être un endormissement et des nausées.
Le monoxyde de carbone est l'un des oxydes du carbone. De formule CO, il se compose d'un atome de carbone et d'un atome d'oxygène. A température ambiante et dans des conditions normales de température, le monoxyde de carbone est incolore et inodore. Il est donc impossible de sentir sa présence pour un homme.
Les intoxications au monoxyde de carbone
Ces intoxications ont souvent lieu l'hiver. Elles sont dues à un mauvais fonctionnement des appareils de chauffage ou à une mauvaise aération. En effet, si un local est trop hermétiquement fermé pour éviter que l'air froid ne rentre, le dioxygène consommé par les combustions n'est pas remplacé. On s'expose alors à deux risques :
La quantité de dioxygène dans l'air étant trop faible, les poumons ne peuvent oxygéner suffisamment le sang et donc le cerveau. Ceci peut entraîner une perte de connaissance, voire la mort.
La quantité de monoxyde de carbone dans l'air augmente, entraînant une intoxication rapide.
Pour supprimer ces deux risques, il faut donc aérer les lieux où sont réalisées des combustions et faire vérifier régulièrement les appareils fonctionnant au gaz.
Les explosions provoquées par le monoxyde de carbone
Dans un brûleur de cuisinière fonctionnant au gaz, la réaction de combustion est contrôlée car le butane et le dioxygène de l'air réagissent au fur et à mesure qu'ils se mélangent. La combustion consomme de petites quantités de réactifs.
Les explosions arrivent quand de grandes quantités de réactifs sont mélangées, à la suite d'une fuite de gaz par exemple. Au contact d'une source de chaleur comme une étincelle, la réaction de combustion démarre et dégage instantanément beaucoup de chaleur, tous les gaz présents se dilatent en produisant le bruit et le souffle de l'explosion.
Les appareils susceptibles de créer du monoxyde de carbone
Tous les appareils dans lesquels se produisent une combustion incomplète peuvent produire du monoxyde de carbone. Cette réaction peut avoir lieu quel que soit le combustible. Cela peut être :
- Du pétrole ;
- Du bois ;
- De l'essence ;
- Du fioul ;
- Du gaz (butane, propane ou autre) ;
- Du charbon ;
- Du gasoil.
Le dégagement de monoxyde de carbone peut avoir lieu pour plusieurs raisons. Il peut s'agir de l'évacuation des fumées qui est mauvaise et donc ces dernières refoulent dans la pièce et se retrouvent dans l'air respiré ou alors il peut s'agir d'un manque d'entretient des appareils de chauffage. En effet, ces derniers s'ils ne sont pas régulièrement entretenus peuvent ne pas laisser passer les bonnes quantités d'air ou de combustible et donc causer des combustions incomplètes, génératrices de monoxyde de carbone.
Pour finir, le non respect des conditions d'utilisation des appareils peut être la cause d'une intoxication au monoxyde de carbone. Il ne faut jamais utiliser un appareil destiné à chauffer à l'extérieur (chauffage au fioul par exemple) dans un espace confiné ou à l'intérieur. Ces derniers ont été conçus pour fonctionner avec la ventilation naturelle de l'air extérieur. Une fois privé de ce dernier, ils peuvent alors fumer et causer des vapeurs nocives.
L'intoxication
Lorsque l'on est victime d'une intoxication au monoxyde de carbone, on peut ressentir certains symptômes. Cependant, c'est qu'il est déjà trop tard et que le gaz toxique a déjà pénétré dans notre organisme.
Voici les symptômes que l'on peut être amenés à ressentir lors d'une intoxication au monoxyde de carbone :
- Maux de tête ;
- Propos incohérents ;
- Fatigue soudaine ;
- Nausées ;
- Vertiges ;
- Malaises ;
- Asthénie.
Dans les cas d'intoxication les plus graves, la personne peut aller jusqu'à se retrouver dans le coma et décéder.
Afin de se protéger des intoxications au monoxyde de carbone, divers solutions existent. On peut par exemple s'équiper d'un détecteur de monoxyde de carbone. Ce dernier vous avertira de la présence de monoxyde de carbone dans l'air, comme le ferait un détecteur de fumée avec un départ de feu.
Des bonnes pratiques existent aussi concernant vos appareils de chauffage. Faites les réviser régulièrement et effectuez des ramonages des conduits d'évacuation des fumées. De plus, même en plein hiver, aérez bien les espaces dans lesquels fonctionnent des appareils de chauffage à combustion et n'obstruez jamais une aération d'air.
Si vous suivez ces bonnes pratiques, vous diminuerez le risque d'intoxication au monoxyde de carbone. Cependant, afin de rendre l'espace encore plus sûr, équipez vos pièces avec des détecteurs de monoxyde de carbone. Faîtes les tester également à intervalles réguliers.
Les différents alcanes alkyle
- butane, 4 atomes de carbone :
- le méthylpropane
- Isomères du pentane, 5 atomes de carbone :
- le méthylbutane, également appelé 2-méthylbutane,isopentane ou 1,1,2-triméthyléthane
- le 2,2-diméthylpropane, aussi appelé tétraméthylméthane, 1,1,1-triméthyléthane ou néopentane
- Isomères de l'hexane, 6 atomes de carbone :
- le 2-méthylpentane
- le 3-méthylpentane
- le 2,2-diméthylbutane
- le 2,3-diméthylbutane
- Isomères de l'heptane, 7 atomes de carbone :
- le 2-méthylhexane ou isoheptane
- le 3-méthylhexane ou 2-éthylpentane
- le 3-éthylpentane
- le 2,2-diméthylpentane
- le 3,3-diméthylpentane ou 2-éthyl-2-méthylbutane
- le 2,3-diméthylpentane
- le 2,4-diméthylpentane
- le 2,2,3-triméthylbutane ou triptane
- Isomères de l'octane, 8 atomes de carbone :
- le 2-méthyleptane
- le 3-méthylheptane
- le 4-méthylheptane
- le 3-éthylhexane
- le 2,2-diméthylhexane
- le 3,3-diméthylhexane ou le 2-éthyl-2-méthylpentane
- le 2,3-diméthylhexane ou le 2-isopropylpentane























Si vous désirez une aide personnalisée, contactez dès maintenant l’un de nos professeurs !
Bjr comment a partir du pH peut on montrer qu’une réaction est limitée
Bonjour je pourrais avoir l’equation bilan d’un alcane dont la combustion est incomplète et qui produit du monoxyde de carbone ?? Car dans la majorité des cas il se produit du carbone et de l’eau .
Merci bien
Bonjour ! Je vous invite à consulter notre cours à ce sujet : https://www.superprof.fr/ressources/scolaire/physique-chimie/terminale-s/limite-reaction-double-sens.html
Bonjour j’aurais une question au niveau d’une espèce chimique polyfonctionnelle.
Je suis perdue dans la façon de nommer une molécule organique, faut-il utiliser les préfixes hydroxy, oxo et amino lors d’une espèce polyfonctionnelle ou faut-il les nommer tout simplement avec les terminaisons correspondante ?
Bonjour ! On parle de molécule organique si elle contient des atomes de carbone (C) et d’hydrogène (H) liés entre eux. Idem pour la manière de nommer !
Bonne journée !