Chapitres

Identifier un alcool
Les alcools sont identifiables grâce à la fonction organique alcool. Elle consiste en un groupe -OH lié à l'un des carbones de la chaîne carbonée d'un alcane. En réalité, il y a trois classes d'alcools. On les distingue en fonction du nombre de groupes alkyles auxquels il est lié. On reviendra plus tard sur l'importance de la distinction des alcools selon leur classe. Le tableau de synthèse à retenir est le suivant :
| Formule générale | Classe |
|---|---|
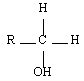 | Primaire |
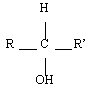 | Secondaire |
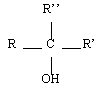 | Tertiaire |

Réaction d'oxydation d'un alcool
Rappels
Les réactions d'oxydo-réduction
Une réaction d'oxydoréduction, également appelée réaction redox, correspond à une réaction chimique au cours de laquelle a lieu un transfert d'électron. C'est-à-dire une réaction durant laquelle une espèce chimique dite oxydant reçoit un ou plusieurs électrons d'une autre espèce chimique dite réducteur. Un oxydant, également appelé agent d'oxydation, correspond à un ion, un corps simple ou un composé qui, lors d'une réaction d'oxydoréduction, reçoit un ou plusieurs électrons d'une autre espèce chimique. Lavoisier mettra en évidence en 1772, suite à ses manipulations du mercure, le rôle du dioxygène dans certaines réactions d'oxydoréduction. D'où le nom oxydation qui signifie "combinaison avec l'oxygène". Un réducteur, également appelé agent de réduction, correspond à un ion, un corps simple ou un composé qui, lors d'une réaction d'oxydoréduction, cède un ou plusieurs électrons à une autre espèce chimique. Réduction quant à lui signifie "l'extraction d'un métal de son oxyde", une définition connue en métallurgie. Les réactions d'oxydo-réduction forment une grande famille puisqu'elles comprennent de nombreuses réactions chimiques. En effet, elles interviennent dans les combustions, certains dosages métallurgiques mais également la corrosion des métaux, l'électrochimie et la respiration cellulaire. Ces réactions sont alors essentielles puisqu'elles jouent un rôle fondamental en biologie : elles permettent la transformation de l'oxygène en eau, de formule H2O, au sein des organismes vivants. Elles sont également massivement utilisées dans l'industrie humaine, notamment afin d'obtenir de la fonte à partir de différents minerais composés d'oxyde de fer grâce à une réduction, puis de fer et d'acier à partir de la fonte grâce à une réaction d'oxydation. Ces différentes utilisations peuvent être expliquée par l'extrême mobilité de l'électron, sa légèreté mais également son omniprésence dans toutes les formes de la matière.
Les demi-équations
Puisque dans une réaction d'oxydo-réduction, le réducteur s'oxyde, c'est la réaction d'oxydation et l'oxydant se réduit, c'est la réaction de réduction, l'oxydoréduction se compose donc de deux demi-réactions : une oxydation et une réduction. Elles se présentent sous la forme suivante :
- Oxydation
- réducteur(1) = oxydant(1) + n e-
- Réduction
- oxydant(2) + n e- = réducteur(2)
- Oxydoréduction qui représente donc la "somme" de l'oxydation et de la réduction
- oxydant(2) + réducteur(1) → oxydant(1) + réducteur(2)
Notons que dans les demi-équation, les flèches n'apparaissent que si la réaction est totale, c'est à dire quand K > 10 000
Le potentiel d'oxydo-réduction
Le caractère oxydant ou réducteur d'une espèce dépend de la réaction chimique et des espèces qui interagissent entre elles. En effet, l'élément réducteur dans une réaction peut devenir l'oxydant d'une autre réaction. C'est pour cela que l'on construit une échelle de force oxydante (ou de force réductrice selon le sens donné à cette échelle) afin d'obtenir le potentiel d'oxydo-réduction se mesurant en volt. En outre, le potentiel d'oxydo-réduction dépend du contexte chimique, notamment du pH, mais aussi du contexte physique puisque les effets de la lumière peuvent intervenir dans la nature comme ce qui est le cas avec la photosynthèse chez les plantes ou la photographie avec l'Homme.
Réaction des alcools

- Les alcools tertiaires ne peuvent pas subir d'oxydation ménagée.
- L'oxydation ménagée des alcools primaires et secondaires peut se faire par trois moyens :
- Par un oxydant en milieu acide (par exemple le permanganate de potassium)
- Par le dioxygène de l'air en présence d'un catalyseur.
- Par déshydrogénation sur du cuivre ou du platine en présence d'un catalyseur.
On arrive à des résultats différents selon la classe de l'alcool qui a été utilisé comme réactif. Certains des produits d'une oxydation ménagée peuvent eux-mêmes subir une réaction d'oxydation ménagée. C'est notamment cette propriété qui nous permettra de tester le produit de la première oxydation ménagée et donc d'en déduire la classe de l'alcool qui l'a subie.
| Classe de l'alcool | Produit de son oxydation | Produit de l'oxydation du produit de son oxydation |
|---|---|---|
| Primaire | Aldéhyde | Acide carboxylique |
| Secondaire | Cétone | Pas d'oxydation ménagée des cétones |
| Tertiaire | Pas d'oxydation ménagée des alcools tertiaires | |
Remarque : le stress oxydatif
Le dioxygène est source de vie pour la majorité des organismes vivants sur terre, cependant il est également responsable de du vieillissement des cellules. En effet, l'oxygène a la propriété de former des radicaux libres, éléments très réactifs allant perturber les processus biologiques. Ainsi, c'est à cause de ces radicaux libres qu'il est possible d'observer la formation de rides de la peau et certains cancers notamment. Chimiquement, on considère un radical libre comme étant est un atome (ou une molécule) qui a perdu ou gagné un électron. Cette entité est par définition très instable car les électrons "veulent" toujours s'apparier (c'est pourquoi les atomes forment des molécules). L'instabilité des radicaux libres leur confère une grande réactivité avec les molécules du vivants. Ils ont en plus tendance à former de nouveaux radicaux libres par échanges d'électrons, ce qui entraîne de nombreuses réactions en chaîne, perturbant le cycle biochimique normal des cellules. Ce phénomène est également appelé stress oxydatif. Ainsi, de nombreuses marques cosmétiques, vantent les mérites de produits anti-oxydants efficaces pour traiter l'apparition des rides. Ces molécules ont la propriété d'être plus facilement attaquée que la peau, et donc échangent préférentiellement les électrons avec les radicaux libres pour former des éléments stables réduisant le risque de réaction en chaîne. Cependant, il ne faut pas rêver : il n'y a pas de miracle ! D'autant que souvent les principes actifs dans les produits cosmétiques ne sont pas très concentrés, ce qui limite leur champ d'action.
Nommer un alcool
Lorsque l'alcool est la fonction principale de la molécule que l'on cherche à nommer, il suffit alors de remplacer la voyelle terminale « e » de l'alcane correspondant à l'alcool que l'on cherche à nommer par le suffixe -ol. Il est ensuite nécessaire d'indiquer le numéro de l'atome de carbone où le groupe hydroxyle est fixé. Même si cette précision n'est pas toujours nécessaire, il est alors possible d'omettre cette précision pour une lecture plus digeste. Si la fonction alcool n'est pas la fonction principale de la molécule, il faut alors ajouter le préfixe hydroxy- précédé du numéro de l'atome de carbone où le groupe est fixé. Ensuite, pour nommer la base conjuguée de l'alcool, comme l'ion alcoolate, il suffit simplement de remplacer la voyelle terminale « e » par le suffixe -olate. Veillez à ne pas confondre avec le suffixe -oate qui est plutôt caractéristique du carboxylate, correspondant alors base conjuguée de l'acide carboxylique.
La théorie VSEPR
Prérequis et supposition
La méthode VSEPR est fondée sur un certain nombre de suppositions qui concernent principalement la nature des liaisons entre atomes :
- les atomes dans une molécule sont liés par des paires d'électrons ;
- deux atomes peuvent être liés par plus d'une paire d'électrons. On parle alors de liaisons multiples ;
- certains atomes peuvent aussi posséder des paires d'électrons qui ne sont pas impliqués dans une liaison. On parle de doublets non liants ;
- les électrons composant ces doublets liants ou non liants exercent les uns sur les autres des forces électriques répulsives. Les doublets sont donc disposés autour de chaque atome de façon à minimiser les valeurs de ces forces ;
- les doublets non liants occupent plus de place que les doublets liants ;
- les liaisons multiples prennent plus de place que les liaisons simples.
Notation
Dans la théorie VSEPR, il y a certains usages de notation à respecter :
- On note l'atome central de la molécule étudiée A.
- Les doublets non-liants, et donc les paires d'électrons appartenant à l'atome central A qui se sont pas impliqués dans les liaisons sont notés E et m leur nombre.
- Les doublets liants, et donc paires d'électrons qui sont impliqués dans des liaisons entre l'atome central A et un autre atome sont notés X. Le nombre de doublets liants sera noté n.
Les molécules simples, dont la géométrie est facilement définissable grâce à la méthode VSEPR sont donc notés suivant la notation vu ci-dessus et se présentent donc sous la forme : AXnEm
Connaissances supplémentaires à avoir
Les boissons alcoolisées
Une boisson alcoolisée, également appelé alcool, correspond à une boisson qui a été fermentée, macérée ou distillées contenant de l'éthanol ou encore un alcool éthylique. Considérée comme étant une drogue dure, elle représente celle qui provoque la plus forte mortalité dans le monde et figure même sur la liste des cancérogènes du groupe 1 du CIRC. On considère l'alcool comme étant responsable de plusieurs millions de morts par an à travers le monde. Le Centre International de Recherche sur le Cancer, également appelé CIRC et nommé International Agency for Research on Cancer en Anglais, correspond à une agence intergouvernementale de recherche sur le cancer. Elle a été créée en 1965 par l'Organisation mondiale de la santé des Nations unies. L'Organisation mondiale de la santé, également appelée OMS, correspond à une institution spécialisée de l'Organisation des Nations unies pour la santé publique. Celle-ci a été créé en 1948 et dépend directement du Conseil économique et social des Nations unies. Son siège se situe à Genève en Suisse, sur la commune de Pregny-Chambésy. La consommation d'alcool provoque chez l'Homme un effet psychotrope que l'on appelle ivresse ou encore intoxication alcoolique mais aussi un risque de dépendance que l'on appelle alcoolisme ou encore alcoolodépendance et d'autres problèmes pour la santé et des risques sociaux comme la violence ou encore les accidents de la route. C'est pour cela que la majorité des pays possède une législation qui réglemente la production, mais également la vente et la consommation de ces boissons alcoolisées. Certains pays ont même opté pour une interdiction totale des boissons alcoolisées même si, dans certains autres pays, la consommation d'alcool est ancrée très profondément dans la culture et poussent donc l'alcool au rang de drogues récréatives la plus ancienne dont la consommation est très fortement banalisée.
L'éthanol
L'éthanol, également appelé alcool éthylique, correspond à un alcool dont la formule semi-développée est CH3-CH2-OH. L'éthanol est un liquide incolore, volatil, miscible à l'eau en toutes proportion et inflammable en plus d'avoir des propriétés psychotropes très connue car l'éthanol correspond à la drogue récréative la plus ancienne lorsqu'il est sous la forme de boissons alcoolisées. Cette molécule est très utilisée par l'industrie agroalimentaire afin de produire des spiritueux mais également par la parfumerie et la pharmacie galénique qui utilise l'éthanol comme solvant. Aujourd'hui, l'éthanol est également très utilisé sous la forme de bioéthanol afin de s'en servir comme biocarburant. Vous pouvez également le retrouver dans les thermomètres à alcool.
TP : Connaître le degré d'alcool d'une boisson

Données
Masses molaires
- M (CH3COOH) = 60,0 g.mol-1
- M (I2) = 254 g.mol-1
- M (NaOH) = 40,0 g.mol-1
- M (SO2) = 64,1 g.mol-1
Les couples acido-basiques
- CH3COOH(aq) / CH3COO-(aq)
- H2O / HO- (aq)
Les couples d'oxydo-réduction
- SO42- / SO2
- I2 / I-
Protocole de l'expérience
Informations
Le dioxyde de soufre est un gaz très soluble dans l'eau. En solution aqueuse, on le trouve sous la forme SO2 (aq)
Teneur en dioxyde de soufre d'un vin blanc
Pour contrôler la qualité d'un vin blanc, on se propose de réaliser sur un échantillon de vin le dosage du dioxyde de soufre dissous présent, SO2 (aq) Pour éviter que le vin ne s'oxyde, on ajoute du dioxyde de souffre au moût de raisin. Dans la législation, la concentration massique en dioxyde de soufre d'un vin blanc est limitée: elle ne doit pas excéder 210 mg.L-1. Pour vérifier la conformité de la concentration de dioxyde de soufre (SO2 (aq)) dans le vin blanc, il existe un protocole opératoire officiel. Pour cela, on utilise une solution titrante de diiode de concentration C(I2) = 7,80.10-3 mol.L-1
- Dans un erlenmeyer, on verse un volume : Vvin = 25,0 mL de vin blanc. On ajoute de l'acide sulfurique pour acidifier le milieu.
- Lors du titrage de l'échantillon, l'équivalence est obtenue après avoir versé un volume : VEq = 6,10 mL de la solution titrante.
- Dans cette réaction, toutes les espèces chimiques sont incolores sauf le diiode qui, en solution aqueuse, est de couleur brune.
Consignes de l'exercice
- Faire le schéma légendé du dispositif de titrage.
- Établir l'équation chimique de la réaction support du dosage. Définir l'équivalence d'un dosage.
- Comment va-t-on repérer l'équivalence de ce dosage?
- Quelle est la quantité de matière de diiode versée à l'équivalence?
- En déduire la concentration molaire en SO2 (aq) , présent dans l'échantillon testé.
- Calculer la concentration massique C, exprimée en mg.L-1 en SO2 (aq), présent dans l'échantillon testé.
- Le vin blanc est-il conforme à la législation ?























Si vous désirez une aide personnalisée, contactez dès maintenant l’un de nos professeurs !
c’est un bon exercice je trouve, mais il n’y a pas de corrigé pour pouvoir s’autoévaluer ou comprendre la réponse… a moins qu’elle y soi et que je ne l’ai pas remarqué :s