Chapitres

Quelques rappels
Généralités

L'oxygène, un atome très abondant
L'oxygène est le troisième élément chimique le plus abondant de l'univers (après l'hydrogène et l'hélium). Sur Terre, il est présent combiné à divers éléments, sous forme d'oxydes minéraux ou au sein de fonctions chimiques des composés organiques (alcool, cétone, acide carboxylique...). Il est présent dans l'air sous forme de dioxygène, dans l'eau combiné avec l'hydrogène et les composés biologiques. Il est vital pour la plupart des organismes vivants sur terre.
En dehors de son rôle biologique, il est également important au développement de la civilisation humaine car est nécessaire à la réalisation de feu.
Attention à ne pas confondre oxygène et dioxygène. En effet, dans le langage courant nous parlons de l'oxygène que nous respirons, mais chimiquement il s'agit de dioxygène (2 atomes d'oxygène). Par exemple, l'oxygène est un constituant de l'eau (H2O, un seul atome d'oxygène), mais du dioxygène existe également dissous dans l'eau (ce qui permet la respiration des organismes aquatiques). 
L'ozone, une molécule très instable
L'ozone est le gaz O3. Il s'agit donc d'une variété allotropique de l'oxygène O. L'ozone tire son nom de l'Allemand Ozon qui est lui même dérivé du Grec ozô signifiant exhaler une odeur. Egalement connu sous le nom de trioxygène, il se présente sous une forme triatomique formées de trois atomes d'oxygène faisant alors de l'ozone une variété allotropique de l'oxygène bien qu'elle soit nettement moins stable que le dioxygène puisque l'ozone tend de façon naturelle à se décomposer.
L'allotropie est la faculté de certains corps simples d'exister sous plusieurs formes cristallines ou moléculaires différentes. Une forme allotropique peuvent avoir des propriétés physique, comme la couleur et la dureté, et une réactivité chimique différentes même si elles sont composées d'atomes identique Les transformations d'une forme allotropique à l'autre peuvent être induites par des changements de pression et de température ou même par une réaction chimique. Certaines formes ne sont stables que sous certaines conditions définies de température et de pression
Lorsque l'ozone se liquéfie à 161,3 K, il se présente sous la forme d'un liquide bleu foncé mais prend la forme d'un solide pourpre dès 80,7 K. Lorsqu'il se trouve à température ambiance, le trioxygène prend la forme d'un gaz bleu pâle à l'odeur très caractéristique. L'instabilité de cette substance se manifeste très largement lorsqu'elle se trouve dans un état condensé. En effet, une tendance à l'explosion se présentera lorsque la concentration en ozone est suffisamment significative. De plus, l'ozone se décompose en dioxygène, de formule O2, à une vitesse variant selon de nombreux paramètres comme la température, l'humidité de l'air, la présence éventuelle de catalyseurs tels que l'hydrogène ou encore un contact ou non avec une surface solide. Alors que le dioxygène reste inodore pour le nez humain, l'ozone peut être détecté par l'Homme dès que sa concentration dépasse les 0,01 ppm. Son odeur est très caractéristique et rappelle beaucoup l'eau de Javel. Il faut néanmoins être prudent car ce gaz peut être toxique lorsqu'il est respiré en grandes quantités et provoque la toux. Bien que l'ozone soit présent de façon naturelle dans l'atmosphère terrestre, formant par ailleurs une couche entre 13 et 40 km d'altitude dans la stratosphère, permettant alors d'intercepter près de 97% des rayons UV du Soleil, l'ozone reste un gaz très polluant pour les basses couches de l'atmosphère comme la troposphère. Lorsqu'il est présent dans cette couche, il va agresser le système respiratoire de la faune et peut même provoquer des brûlures chez la partie la plus sensible de la flore. En effet, l'ozone est un oxydant qui va agir sur les cellules vivantes et provoquer une corrosion accélérée des polymères. On appelle ce phénomène le craquelage d'élastomères par l'ozone. L'ozone est une substance chimique qui possède une demi-vie relativement courte et cela est encore plus marquant lorsque la réaction se produit dans l'eau où il se décomposera en radicaux -OH. Cependant, et comme cela a pu être dit précédemment, différents facteurs peuvent influencer la vitesse de décomposition de l'ozone.
La demi-vie correspond au temps mis par une substance afin de perdre la moitié de son activité pharmacologique ou physiologique.

Alcane
D'une manière synthétique, la nomenclature utilise le nom de l'alcane que constitue la chaîne carbonée et lui ajoute un suffixe qui traduit la fonction organique portée par la molécule. Afin de garantir la bonne compréhension des explications qui suivront, on rappelle ici les dénominations des alcanes ainsi que vus en seconde :
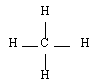 Méthane | 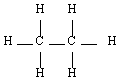 Ethane | 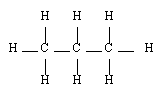 Propane |
|---|---|---|
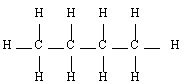 Butane | 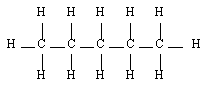 Pentane | 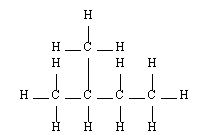 2-méthyl-butane |
Alcool

| Formule générale | Classe | Exemple | Nom |
|---|---|---|---|
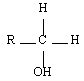 | Primaire | 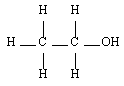 | Ethanol |
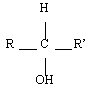 | Secondaire | 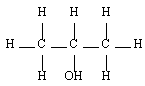 | Propan-2-ol |
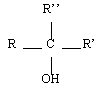 | Tertiaire | 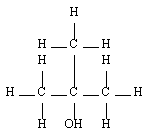 | Méthyl-propan-2-ol |
| Formule générale développée | Exemple | Nom |
|---|---|---|
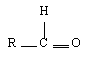 | 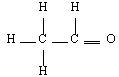 | Ethanal |
| Formule générale développée | Exemple | Nom |
|---|---|---|
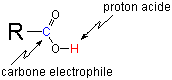 | 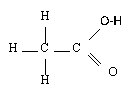 | Acide éthanoïque |
| Formule générale développée | Exemple | Nom |
|---|---|---|
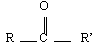 |  | Butanone |
Les réactions d'oxydo-réduction
Une réaction d'oxydoréduction, également appelée réaction redox, correspond à une réaction chimique au cours de laquelle à lieu un transfert d'électron. C'est-à-dire une réaction durant laquelle une espèce chimique dite oxydant reçoit un ou plusieurs électrons d'une autre espèce chimique dite réducteur. Un oxydant, également appelé agent d'oxydation, correspond à un ion, un corps simple ou un composé qui, lors d'une réaction d'oxydoréduction, reçoit un ou plusieurs électrons d'une autre espèce chimique. Lavoisier mettra en évidence en 1772, suite à ses manipulation du mercure, le rôle du dioxygène dans certaines réactions d'oxydoréduction. D'où le nom oxydation qui signifie "combinaison avec l'oxygène". Un réducteur, également appelé agent de réduction, correspond à un ion, un corps simple ou un composé qui, lors d'une réaction d'oxydoréduction, cède un ou plusieurs électrons à une autre espèce chimique. Réduction quant à lui signifie "l'extraction d'un métal de son oxyde", une définition connue en métallurgie. Les réactions d'oxydo-réduction forment une grande famille puisqu'elles comprennent de nombreuses réactions chimiques. En effet, elles interviennent dans les combustions, certains dosages métallurgique mais également la corrosion des métaux, l'électrochimie et la respiration cellulaire. Ce réactions sont alors essentielles puisqu'elles jouent un rôle fondamental en biologie : elles permettent la transformation de l'oxygène en eau, de formule H2O, au sein des organismes vivants. Elles sont également massivement utilisées dans l'industrie humaine, notamment afin d'obtenir de la fonte à partir de différents minerais composés d'oxyde de fer grâce à une réduction, puis de fer et d'acier à partir de la fonte grâce à une réaction d'oxydation. Ces différents utilisations peuvent être expliquée par l'extrême mobilité de l'électron, sa légèreté mais également son omniprésence dans toutes les formes de la matière.
Les demi-équations
Puisque dans une réaction d'oxydo-réduction, le réducteur s'oxyde, c'est la réaction d'oxydation et l'oxydant se réduit, c'est la réaction de réduction, l'oxydoréduction se compose donc de deux demi-réactions : une oxydation et une réduction. Elles se présentent sous la forme suivante :
- Oxydation
- réducteur(1) = oxydant(1) + n e-
- Réduction
- oxydant(2) + n e- = réducteur(2)
- Oxydoréduction qui représente donc la "somme" de l'oxydation et de la réduction
- oxydant(2) + réducteur(1) → oxydant(1) + réducteur(2)
Notons que dans les demi-équation, les flèches n'apparaissent que si la réaction est totale, c'est à dire quand K > 10 000
Le potentiel d'oxydo-réduction
Le caractère oxydant ou réducteur d'une espèce dépend de la réaction chimique et des espèces qui interagissent entre elles. En effet, l'élément réducteur dans une réaction peut devenir l'oxydant d'une autre réaction. C'est pour cela que l'on construit une échelle de force oxydante (ou de force réductrice selon le sens donné à cette échelle) afin d'obtenir le potentiel d'oxydo-réduction se mesurant en volt. En outre, le potentiel d'oxydo-réduction dépend du contexte chimique, notamment du pH, mais aussi du contexte physique puisque les effets de la lumière peuvent intervenir dans la nature comme ce qui est le cas avec la photosynthèse chez les plantes ou la photographie avec l'Homme.
Les oxydations
On a déjà pu étudier la signification du terme d'oxydation et les particularités de la réaction qu'il recouvre. Dans le cas précis de l'oxydation des alcools, il faut noter que l'on parle d'oxydation ménagée parce qu'il n'y a pas de rupture des liaisons entre les atomes de carbones. Ces liaisons sont maintenues aussi ne parle-t-on pas d'une réaction complète puisque la destruction de ces liaisons n'a pas lieu. Il s'agit d'une réaction ménagée parce qu'elle conserve le squelette carboné de la molécule. La classe de l'alcool qui subit l'oxydation ménagée va déterminer la nature de ses produits :
- les alcools tertiaires ne peuvent pas subir d'oxydation ménagée.
- L'oxydation ménagée des alcools primaires et secondaires peut se faire par trois moyens :
- Par un oxydant en milieu acide ( par exemple le permanganate de potassium)
- Par le dioxygène de l'air en présence d'un catalyseur.
- Par déshydrogénation sur du cuivre ou du platine en présence d'un catalyseur.
On arrive à des résultats différents selon la classe de l'alcool qui a été utilisé comme réactif. Certains des produits d'une oxydation ménagée peuvent eux-même subir une réaction d'oxydation ménagée. C'est notamment cette propriété qui nous permettra de tester le produit de la première oxydation ménagée et donc d'en déduire la classe de l'alcool qui l'a subie.
| Classe de l'alcool | Produit de son oxydation | Produit de l'oxydation du produit de son oxydation |
|---|---|---|
| Primaire | Aldéhyde | Acide carboxylique |
| Secondaire | Cétone | Pas d'oxydation ménagée des cétones |
| Tertiaire | Pas d'oxydation ménagée des alcools tertiaires | |

L'oxygène et le stress oxydatif
Le dioxygène est source de vie pour la majorité des organismes vivants sur terre, cependant il est également responsable de du vieillissement des cellules. En effet, l'oxygène a la propriété de former des radicaux libres, éléments très réactifs allant perturber les processus biologiques. Ainsi, c'est à cause de ces radicaux libres qu'il est possible d'observer la formation de rides de la peau et certains cancers notamment. Chimiquement, on considère un radical libre comme étant est un atome (ou une molécule) qui a perdu ou gagné un électron. Cette entité est par définition très instable car les électrons "veulent" toujours s'apparier (c'est pourquoi les atomes forment des molécules). L'instabilité des radicaux libres leur confère une grande réactivité avec les molécules du vivants. Ils ont en plus tendance à former de nouveaux radicaux libres par échanges d'électrons, ce qui entraîne de nombreuses réactions en chaîne, perturbant le cycle biochimique normal des cellules. Ce phénomène est également appelé stress oxydatif. Ainsi, de nombreuses marques cosmétiques, vantent les mérites de produits anti-oxydants efficaces pour traiter l'apparition des rides. Ces molécules ont la propriété d'être plus facilement attaquée que la peau, et donc échangent préférentiellement les électrons avec les radicaux libres pour former des éléments stables réduisant le risque de réaction en chaîne. Cependant, il ne faut pas rêver, il n'y a pas de miracle ! D'autant que souvent les principes actifs dans les produits cosmétiques ne sont pas très concentrés, ce qui limite leur champ d'action.
L'électrolyse : quand on force l'oxydation
Pour obtenir une électrolyse, il faut imposer une tension électrique entre deux électrodes plongées dans une solution dite électrolytique. Ainsi, on peut forcer un transfert d'électron d'un oxydant vers un réducteur. L'électrolyse permet alors de provoquer des transformations dites forcées. Ce procédé est régulièrement utilisé afin de purifier les métaux tels que le cuivre ou encore pour protéger le fer de la corrosion par électrozingage. Vous pouvez également utiliser cette technique pour embellir votre service de couvert en les argentant ou pour récupérer différentes substances telles que de l'aluminium ou du dichlore.
L'électrozingage repose sur le dépôt d'électrolyte de zinc sur le fer afin de le protéger grâce à l'obtention d'un revêtement protecteur. On dit alors du fer qu'il est électrozingué.
Dans l'industrie, afin d'affiner du cuivre brut, on utilise le cuivre en tant qu'anode dans un bain de sulfate de cuivre afin de procéder à une électrolyse. Ainsi, du cuivre pur jusqu'à un pourcentage de 99,95% se fixera sur la cathode alors que les impuretés resteront dans le bain de sulfate de cuivre.
Quelques tests permettant de reconnaître des groupements.
Test à la 2, 4DNPH
La 2, 4 Dinitrophénylhydrazine caractérise les fonction aldéhydes et cétones en donnant avec elles un précipité jaune-orangé abondant.
Test au réactif de Tollens
Il s'agit du nitrate ammoniacal qui agit comme un oxydant en milieu basique et est réduite en argent métallique par la présence d'un aldéhyde qui agit alors comme un réducteur.

Test à la liqueur de Fehling
La liqueur de Fehling agit comme un oxydant basique contenant des ions Cu2+ sous une forme dite complexée. Ces ions lui donnent une coloration bleu-roi et ils sont réduits par des aldéhydes si l'on procède à un chauffage modéré. La solution prend alors une coloration rouge brique.

Les pièges de la leçon
- bien faire attention aux coefficients stoechiométriques.























Si vous désirez une aide personnalisée, contactez dès maintenant l’un de nos professeurs !