Chapitres

Pourquoi faire des mesures de quantité de matière ?
Les mesures de quantité de matière en chimie sont utiles pour comprendre le monde qui nous entoure, la manière dont il évolue et ainsi prévoir le futur. Par exemple, le taux de CO2 dans l'air permet de savoir s'il y aura réchauffement.
Elles servent aussi à protéger des substances qui peuvent être dangereuses pour l'homme. Par exemple, le taux d'alcool dans le sang.
De façon générale, mesurer la quantité de matière permet d'améliorer notre qualité de vie.
On dénombre des objets avec des molles dans tous les domaines d'analyse (biologie, composition d'un aliment, etc.). Dans l'expertise scientifique, on examine des quantités de matières régulièrement.

Quantité de matière d'un solide et d'un liquide
Définitions
Quantité de matière, noté n : une quantité de matière représente un nombre de « paquets » d'entités chimiques identiques. Elle est noté n et s'exprime en mol.
La constante d'Avogadro, noté NA : la constante d'Avogadro est le nombre qui permet de relier une quantité de matière n d'un échantillon au nombre N d'entités identiques. Elle est exprimée sans unité et notée Na (Na = 6,022.1023).
Mole : une mole est un paquet de 6,022.1023 entités chimiques identiques.
Masse molaire, noté M : la masse molaire attribuée a un élément chimique est la masse d'une mole d'atomes de cet élément chimique. Elle s'exprime en gramme par mole(g.mol-1).
Masse molaire d'une espèce chimique, noté M : masse d'une mole de cette espèce chimique. Elle se calcule à partir des masses molaires attribuées à chaque élément chimique présente dans sa formule.
Volume molaire, noté Vm : le volume molaire Vm d'une espèce chimique est le volume occupé par une mole de cette espèce chimique.
Concentration molaire, noté c : la concentration molaire d'une espèce chimique en solution est la quantité de matière de soluté présente par litre de solution.
Grandeur quantité de matière : η
En chimie, la quantité de matière correspond à un nombre fixé d'éléments (atomes, molécules, ions...). On la définit : un mole est le nombre d'éléments contenus dans 12g de carbone 12. C'est l'unité de la quantité de matière.
Le nombre d'éléments dans une mole est le nombre d'Avogadro Na = 6,02 1023 mol-1.
La quantité de matière η d'un échantillon est le rapport du nombre d'élément N qu'il contient sur le nombre d'Avogadro.
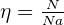
Avec :
- N, nombre de mol, sans unité ;
- Na : nombre dAvogadro en mol.
Quantité de matière et masse
Pour faire le lien entre masse et quantité de matière, les chimistes utilisent les masses molaires atomiques MX.
La masse molaire atomique d'un élément X est la masse d'une mole de cet atome. On la note MX est se mesure en g/mol.
Toutes les masses atomiques figurent dans le tableau périodique des éléments.
La masse molaire moléculaire d'une molécule AaBb, est la somme pondérée des masses molaires atomiques des éléments qui la constitue.
M(AaBb) = aM(A) + bM(B).
La masse d'un échantillon m contient une quantité de matière η déterminée grâce à la masse molaire de l'élément constituant l'échantillon.
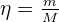
Avec :
- m : masse en grammes ;
- M : masse molaire en g.mol-1.

Quantité de matière et volume
Pour faire le lien entre masse et volume, on utilise la masse volumique ρ définit comme la masse d'un échantillon sur le volume qu'il occupe.
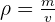
La plupart du temps, on se réfère à la densité d'un corps. C'est à dire au rapport entre sa masse volumique et celle d'un corps de référence (l'eau).

A l'aide de la masse volumique, on peut déduire l'expression de la quantité de matière.

Concentration et quantité de matière
Les liquides et les solides forment des solutions aqueuses lorsqu'ils sont dissous dans l'eau. On calcule leur concentration massique ou titre massique en faisant le rapport entre la masse de soluté introduite et le volume de solvant.

De la même manière, les chimistes utilisent la concentration molaire qui est le rapport entre quantité de matière introduite et le volume de solvant.

La quantité de matière n(x) a un échantillon d'une espèce chimique x de masse m(x) est donné par la relation suivante :
n(x) = m(x) / M(x)
avec :
- n(x) : quantité de matière en mol ;
- m(x) : masse en g ;
- M(x) : masse molaire en g.mol-1 .
d'où :
m(x) = n(x) * m(x)
et
M(x) = m(x) / n(x)
Le Volume V(x) d'un échantillon d’espèce chimique x et sa quantité de matière n(x) sont reliés par la relation :
n(x) = V(x) / V(m)
avec :
- n(x) en mol ;
- V(x) en L ;
- Vm en L.mol-1.
L'unité de la matière : la mole
Définitions
La quantité de matière est noté : n.
Mole = mol = unité de quantité de matière (n).
La Mole est la réunion d'un nombre bien déterminé (6,02.1023) d’entités élémentaires. On appelle ce nombre le nombre d'Avogadro.
Constante d'Avogadro = 6,02.1023 (correspond au nombre d'atomes de carbone 12 contenu dans 12,0 g de carbone 12). On la note Na = nombre d'entités élémentaires contenues dans 1 mole.
Na=6,02.1023 mol-1
La quantité de matière (n) d'un échantillon est égale au rapport de nombre N de ces entités élémentaires par le nombre d'Avogadro Na.
La mole est une unité faisant partie intégrante du Système International. Elle a commencé à être utilisée en 1971.
Le système international d'unités, abrégé en SI, est le système décimal des unités de mesures le plus utilisé au monde. L’ensemble des unités associées aux dimensions fondamentales constitue le système international d’unités. Il s’agit du système MksA (mètre, kilogramme, seconde, Ampère), mais le Kelvin, la mole et le candela font aussi partie de ce système. Ces unités sont appelées unités légales. Elles sont universelles et connues de par le monde entier
Pourquoi avoir créé cette unité ?
Lorsque l'on compte de grandes quantités, il est intéressant de définir un paquet de référence, dont on se servira pour calculer les grands nombres.
De nombreuses unités ont vu le jour selon ce principe. C'est le as par exemple de l'année lumière qui permet de calculer des distances astronomiques .
La masse molaire
M = masse d'atome de cet élément, elle est noté Mx et exprimé en g.mol-1. On les trouve dans le tableau des classification périodiques des éléments.
Masse molaire moléculaire - Masse d'une molle de molécule
Ex : H2O = m(H2O)=2m(H)+m(O) masse Na Na*m(H2O)=2Na*m(H)+Na*m(O) M(H2O)=2*M(H)+M(O) Elle s'obtient en faisant les sommes des masses molaires atomiques et des atomes qui constitue la molécules.
La masse d'une mole d'atomes est appelée masse molaire atomique, noté M et d'unité g / mol. En chimie, on ne compte pas en nombre d'ions ou d'atomes mais en nombre de paquets, un paquet s'appelle une mole (mol). Une mole contient 6,02 x 1023 entités. Le nombre de masse d’un atome correspond au nombre de nucléons qu’il contient. Il s’agit donc de la somme du nombre de protons et du nombre de protons qui constituent le noyau de l’atome. La masse molaire correspond aussi au nombre de nucléons dans le noyau. A = 59, signifie qu'il y a 56 nucléons dans le noyau (et 59 grammes dans une mole). Dans le tableau périodique, la masse molaire est souvent différente de A à cause des isotopes. Des isotopes sont des atomes qui possèdent le même nombre de protons mais un nombre différent de neutrons.
Les gaz
Équation d'état des gaz parfaits
Un gaz est dit parfait lorsque les particules qui le constituent sont sans interaction les unes aux autres. C'est le cas quand la pression d'un gaz quelconque est très faible. Les gaz parfaits obéissent à une loi régissant des grandeurs : pression, volume, température.
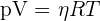
Le volume molaire d'un gaz est par définition le rapport entre le volume de ce gaz et de sa quantité de matière.
Or d'après la loi des gaz parfaits, ce rapport est constant si T et p sont constantes.
Rappel : La température prise en compte est la température absolue t(K) = 0 °C + 273,15 F
Masse d'un gaz
La masse d'un gaz est difficile d'accès, par conséquent pour connaître sa valeur, on préfèrera connaître son volume et le convertir grâce à la masse volumique.
m = ρ V
Remarque :
La densité d'un gaz se mesure en prenant pour référence la masse volumique de l'air. Dans ces conditions normales, la masse volumique de l'aire est à 1,3 g/L.

Travailler avec les moles
Réaliser une dilution
On note la concentration d'une solution C et il est possible de la calculer avec la formule suivante : 
Avec :
- C la concentration molaire. Cette unité s'exprime en mol.L-1 ;
- n la quantité de matière du soluté en solution. Cette unité s'exprime en mol ;
- Et V le volume de solvant. Cette unité s'exprime en L.
Ainsi, si on procède à une dilution par ajout de solvant, la solution initiale et la solution finale contiennent autant de quantité de soluté. Cela signifie alors que ninitiale = nfinale .
On a alors les relations suivantes qui se dégagent :


On peut déduire de ces relations le rapport suivant :

Taux de dilution
Il est possible d'exprimer le taux de dilution avec la relation suivante :

Il est important de savoir que le taux de dilution, noté T, est une grandeur sans unité et qui présente obligatoirement une valeur positive et inférieure à 1.
Quant au taux de dilutions successives, il correspond au produit des taux de dilution de chaque dilution.
Les dosages colorimétriques
Un dosage colorimétrique correspond à un type de dosage qu'il est possible de réaliser lorsqu'une réaction chimique donne des produits colorées et si l'intensité de la coloration est proportionnelle à la concentration de l'élément chimique à doser. Cette réaction repose donc logiquement sur la loi de Beer-Lambert.
Notez qu'il est aussi possible de procéder à un dosage colorimétrique en utilisant des indicateurs colorés qui vont se colorer selon les variations de pH et donc indiquer le point d'équivalence de la réaction. Dans ce cas, on parle alors de titrage colorimétrique.
Pour procéder à un tel dosage, il est alors nécessaire de procéder à la conception d'une gamme étalon.
Calculer l'avancement d'une réaction
Si on ne prend en compte que le cas particulier d’une réaction ayant lieu en solution aqueuse telle que le volume V de la solution soit constant, alors on peut utiliser l’expression suivante :
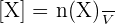
Avec :
- [X] représentant la concentration molaire en mol.L-1 ;
- n(X) représentant la quantité de matière de l’espèce X en solution en mol ;
- V représentant le volume de la solution en L.
D’après ce qui précède, en divisant tous les termes de la relation de définition de l’avancement par V :
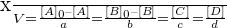
Exercices d'application
Voilà quelques exercices qui vous aideront à vous préparer dans le comptage de moles pour l'examen du BAC.
Exercice 1 : La pile au cuivre

Une pile est composée de deux demi-piles reliées par un pont salin (papier filtre imbibé d’une solution de chlorure de potassium). La première demi-pile est constituée d’une lame d’aluminium de masse m1 = 1,0 g qui plonge dans 50 mL de solution de sulfate d’aluminium (2Al3+(aq) + 3SO42-(aq)) de concentration en ion aluminium [Al3+(aq)] = 5,0.10-1 mol.L-1. La seconde est constituée d’une lame de cuivre de masse
m2 = 8,9 g qui plonge dans 50 mL de solution de sulfate de cuivre (Cu2+(aq) + SO42-(aq)) de concentration [Cu2+(aq)] = 5,0.10-1 mol.L-1.
On associe à cette pile un ampèremètre et une résistance en série.
1. Réaliser le schéma annoté de la pile.
2. L’ampèremètre indique que le courant circule de la plaque de cuivre vers la plaque d’aluminium à l’extérieur de la pile. Préciser, en le justifiant, la polarité de la pile. Compléter votre schéma en indiquant cette polarité.
3. L’équation d’oxydoréduction de fonctionnement de la pile est :
3 Cu2+(aq) + 2Al(s) = 3 Cu(s) + 2 Al3+(aq) (1)
Écrire les équations des réactions se produisant à chaque électrode.
4. La constante d’équilibre associée à l’équation (1) est K = 10200.
4.1 Déterminer le quotient initial de réaction du système ainsi constitué.
4.2 Le sens d’évolution du système étudié est-il cohérent ?
5. Étude de la pile en fonctionnement.
5.1 Déterminer les quantités de matière initiales en moles des réactifs de l’équation chimique (1). En déduire la valeur de l’avancement maximal.
5.2 Calculer la quantité maximale d’électricité que peut débiter cette pile.
Données :
- F = 9,6.104 C.mol-1 ; M(Al) = 27,0 g.mol–1 ; M(Cu) = 63,5 g.mol–1
- Couples redox :
- Cu2+(aq) / Cu(s)
- Al3+(aq) / Al(s)
Tableau descriptif du système :
| Équation | 3 Cu2+aq + 2 Al s = 3 Cus + 2 Al3+aq | ||||
|---|---|---|---|---|---|
| État du système | Avancement (mol) | Quantités de matière (mol) | |||
| État initial | 0 | 14.10-2 | 2,5.10-2 | ||
| En cours de transformation | x | ||||
Exercice 2 : Les indicateurs colorés naturels de la cuisine à la chimie
La première utilisation d'un indicateur coloré pour les titrages acido-basiques remonte à 1767 par W. Lewis. Il employait un extrait de tournesol.
On utilisait à l'époque des extraits de plantes qui changent de couleur avec l'acidité du milieu.
On peut en citer quelques-uns parmi les plus connus et les meilleurs :
- L'artichaut ;
- La betterave rouge ;
- Le chou rouge, de loin l'extrait le plus intéressant car sa couleur change nettement suivant la valeur du pH :
- Entre 0 et 3 : rouge ;
- Entre 4 et 6 : violet ;
- Entre 7 et 8 : bleu ;
- Entre 9 et 12 : vert ;
- Entre 13 et 14 : jaune.
1. Des indicateurs colorés en cuisine
Le chou rouge est un légume riche en fibres et en vitamines, qui se consomme aussi bien en salade
que cuit.
Mais la cuisson du chou rouge peut réserver des surprises : chou rouge et eau de cuisson deviennent rapidement bleus. Pour rendre au chou sa couleur violette, on peut ajouter un filet de citron ou du vinaigre.
Après avoir égoutté le chou, une autre modification de couleur peut surprendre le cuisinier : versée dans un évier contenant un détergent, l'eau de cuisson devient verte.
En utilisant les textes ci-dessus,
1.1 Donner la propriété essentielle d'un indicateur coloré acido basique.
1.2 Préciser le caractère acide ou basique du vinaigre et du détergent.
2. Des indicateurs colorés pour les titrages
De nos jours, les indicateurs colorés sont toujours largement utilisés pour les titrages. La pH-métrie
est une autre technique de titrage acido-basique qui permet en outre de choisir convenablement un indicateur coloré acido-basique pour ces mêmes titrages.
Dans la suite de l'exercice, on s'intéresse au titrage de l'acide éthanoïque de formule CH3 – CO2H
(noté par la suite HA) contenu dans un vinaigre commercial incolore.
La base conjuguée de cet acide sera notée A– .
2.1 Dilution du vinaigre
Le vinaigre commercial étant trop concentré pour être titré par la solution d'hydroxyde de sodium disponible au laboratoire, on le dilue dix fois. On dispose pour cela de la verrerie suivante :
| Eprouvettes | 5 mL | 10 mL | 25 mL | 50 mL | 100 mL |
|---|---|---|---|---|---|
| Pipettes jaugées | 1,0 mL | 5,0 mL | 10 mL | 20,0 mL | |
| Fioles jaugées | 150,0 mL | 200,0 mL | 250,0 mL | 500,0 mL |
Choisir dans cette liste la verrerie la plus appropriée pour effectuer la dilution. Justifier.
2.2 Réaction de titrage.
On titre un volume VA = 10,0 mL de la solution diluée de vinaigre par une solution aqueuse d'hydroxyde de sodium (ou soude) de concentration molaire en soluté apporté cB = 1,0 . 10–1 mol.L-1.
On ajoute un volume Veau = 60 mL afin d'immerger les électrodes du pH-mètre après agitation.
Cette partie a pour but de vérifier que la transformation associée à la réaction de titrage est totale.
Pour cela, on déterminera son taux d'avancement final pour un volume VB = 6,0 mL de solution aqueuse d'hydroxyde de sodium versé.
Cette partie a pour but de vérifier que la transformation associée à la réaction de titrage est totale.
Pour cela, on déterminera son taux d'avancement final pour un volume VB = 6,0 mL de solution aqueuse d'hydroxyde de sodium versé.
Donnée : produit ionique de l'eau à 25°C Ke = 10 –14
2.2.1 Écrire l'équation associée à la réaction de titrage.
2.2.2 Pour VB = 6,0 mL, déterminer le réactif limitant.
2.2.3 Pour VB = 6,0 mL, déterminer l'avancement maximal xmax . On pourra s'aider d'un tableau d'avancement.
2.2.4 Après avoir relevé la valeur du pH du mélange obtenu, déterminer la quantité de matière d'ions hydroxyde restante après la transformation (n)f dans le volume total de mélange réactionnel.
2.2.5 Déterminer le taux d'avancement final et conclure.
2.3 Détermination par titrage de la concentration molaire en acide éthanoïque apporté du vinaigre.
2.3.1 Déterminer graphiquement le volume de la solution d'hydroxyde de sodium versé à l'équivalence. Préciser la démarche utilisée.
2.3.2 Déterminer la valeur de la concentration molaire en acide éthanoïque apporté cA dans le vinaigre dilué et en déduire la valeur de la concentration molaire en acide éthanoïque apporté c0 du vinaigre commercial.
2.4 Retour historique
On souhaite réaliser un titrage colorimétrique de l'acide éthanoïque contenu dans le vinaigre dilué avec un des deux extraits naturels (artichaut et betterave rouge) utilisés au dix huitième siècle.
Pour chaque indicateur coloré, on considère que les teintes sont dues à la prédominance d'une espèce chimique, notée HAInd pour sa forme acide et A–Ind pour sa forme basique. Le pKa des couples HAInd/ A–Ind sera noté pKi.
On donne les valeurs des pKi à 25°C :
- Artichaut: (pKi )1 = 7,5 ;
- Betterave rouge: (pKi)2 = 11,5.
| Artichaud | Betterave | |
|---|---|---|
| pKi | 7,5 | 11,5 |
| Teinte HAInd dominant | incolore | rouge |
| Teinte A–Ind dominant | jaune | jaune |























Si vous désirez une aide personnalisée, contactez dès maintenant l’un de nos professeurs !