Chapitres
La solubilité reflète la capacité d’une espèce chimique à se dissoudre dans un solvant donné : plus on peut dissoudre une quantité importante d’une substance dans un liquide et plus sa solubilité est grande.

Techniques utiles pour les mélanges
Voici quelques techniques que vous rencontrerez lors de vos TP ou lors des exercices.
Décoction (ou infusion)
On laisse le végétal en contact avec l'eau chaude. Les espèces chimiques contenues vont se solubiliser. ex: le thé.
Macération
Même chose avec l'alcool. ex: fruit à l'alcool. Les espèces chimiques contenues vont se solubiliser dans l'alcool.
Hydrodistillation ou entrainement à la vapeur
Le but de cette manipulation est d'extraire par hydrodistillation l'huile essentielle de l'espèce chimique. On a par exemple l'extraction de l'huile essentielle contenue dans les fleurs de lavande.
Distillation

En effet, c'est par ces méthodes que l'on extrait les huiles essentielles des plantes nécessaires à la confection de la fragrance.
Extraction par solvant
Même principe que la décoction sauf qu'on utilise des solvants organiques issus du pétrole.
Exercice 1
- Définir : un mélange homogène, un mélange hétérogène, une solution aqueuse, liquides miscible.
- Complète le tableau suivant :
| Mélange | Hétérogène ou homogène | Etats | Méthode de séparation |
|---|---|---|---|
| homogène | Liquide-liquide | ||
| hétérogène | Liquide-liquide | ||
| Eau boueuse | |||
| Sang | |||
| Eau salé | |||
| Lentille et riz | |||
| Lentille et fer |
Solution exercice 1
- Un mélange homogène est un mélange formé d’une seule phase
Un mélange hétérogène est un mélange formé de 2 ou plusieurs phases Une solution aqueuse est une solution qui a eu l’eau comme solvant Les liquides miscibles sont qui donnent un mélange homogène lorsqu’on les mélanges.
| Mélange | Hétérogène ou homogène | Etats | Méthode de séparation |
|---|---|---|---|
| Eau et alcool | homogène | Liquide-liquide | distillation |
| Eau et huile | hétérogène | Liquide-liquide | décantation |
| Eau boueuse | homogène | Liquide-solide | décantation |
| Sang | homogène | Liquide-solide | centrifugation |
| Eau salé | homogène | Liquide-solide | distillation |
| Lentille et riz | hétérogène | Liquide-solide | triage manuel |
| Lentille et fer | hétérogène | Liquide-solide | aimantation |
- source de chaleur (ici, un brûleur Bunsen) ;
- ballon à distiller ;
- tête de distillation ;
- thermomètre ;
- réfrigérant à eau ;
- entrée d'eau de refroidissement ;
- sortie d'eau de refroidissement ;
- ballon de réception des gouttes de distillat ;
- vers une pompe à vide éventuelle ;
- adaptateur pour la pompe à vide.
La distillation est un procédé de séparation de mélange de substances liquides dont les températures d'ébullition sont différentes. Elle permet de séparer les constituants d'un mélange homogène. Sous l'effet de la chaleur, les substances se vaporisent successivement, et la vapeur obtenue est liquéfiée pour donner le distillat.
Exercice 2
L'eau de coco
L’eau de coco est populaire chez les sportifs car elle contient :
- Des minéraux tels que le potassium, le sodium, le magnésium, perdus en grande quantité par les sportifs pendant l’effort ;
- Des vitamines ;
- Très peu de calories.
Questions
- Le pH de l’eau de coco est un critère important pour s’assurer de sa qualité.
- Indiquer le matériel nécessaire pour mesurer un pH ;
- On récupère l’eau d’une noix de coco dans un bécher. Proposer un protocole expérimental pour mesurer le pH de cette eau ;
- Le pH mesuré est égal à 5. Préciser si cette eau de coco est acide, basique ou neutre. Justifier la réponse.
- Une eau de coco de bonne qualité est légèrement acide.
- Indiquer quels sont les ions responsables de l’acidité d’une solution.
- Expliquer pourquoi il est préférable pour un sportif de transporter l’eau de coco dans une gourde en plastique, plutôt que dans une gourde en aluminium.
Exercice 3
Compléter le texte suivant
Un mélange dans lequel on distingue au moins deux constituants est un mélange _____ Lors d'une _____ les matières solides en suspension dans un liquide se déposent au fond du récipient. Lors d'une _____ les particules solides sont retenues par le et le liquide obtenu est un mélange homogène. L'eau minérale est un _____ parce qu'elle contient d'autres substances que l'eau. La _____ permet de séparer les constituants d'un mélange homogène. La _____ permet de séparer les différents pigments d'un mélange.
Exercice 4
La sauce tomate et son acidité 
Sujet
Pour diminuer l’acidité de la sauce tomate, la grand-mère de Bastien, fine cuisinière, dit qu’il faut lui rajouter un demiverre d’eau dans lequel on a dissous une demi-cuiller à café de bicarbonate de soude. Le bicarbonate de soude est le nom commercial d’une espèce chimique appelée également : hydrogénocarbonate de sodium de formule : NaHCO3. Le bicarbonate de soude est une espèce chimique soluble dans de l’eau.
Questions
Compléter le tableau avec les composants de l'eau
| Symbole | Nom de l’élément chimique | Nombre d’atome(s) présent(s) dans l’eau |
|---|---|---|
| H | ||
| oxygène |
Au laboratoire, on dispose d’un litre d’eau, on y verse 120 g de bicarbonate de soude, et on agite pendant une minute. Décrire succinctement ce que l’on observe.
Donner la définition de la solubilité d’un composé dans l’eau.
Au laboratoire, on cherche à déterminer le pH d’une solution aqueuse de bicarbonate de soude à l’aide de papier pH. On dépose une goutte de cette solution sur un petit bout de papier pH. On donne :
| Gamme de couleur du papier pH | Rose vif | Rouge | Rouge orangé | Orangé | Jaune ocre | Jaune kaki | Vert | Vert foncé | Bleu | Bleu foncé |
|---|---|---|---|---|---|---|---|---|---|---|
| Valeur du pH mesuré | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
Le papier pH mis en contact avec la solution prend une teinte vert foncé. Donner la valeur du pH de cette solution.
Indiquer la nature de cette solution (acide, neutre ou basique).
Choisir, parmi les ions suivants, celui dont la présence est responsable de la nature de la solution :
- Cl - ;
- Na + ;
- HO - ;
- Ca 2+.
La transformation chimique qui a lieu dans la casserole se traduit par l'équation de réaction suivante : [ H ^ { + } + H C O _ 3 ^ - \rightarrow H _ { 2 } O + C O _ { 2 } ]
Ecrire la formule des réactifs de cette transformation.
Choisir parmi les actions suivantes ce que traduit cette équation (plusieurs réponses possibles)
- Disparition de l’espèce H+ ;
- Apparition de l’espèce H+ ;
- Disparition de l’espèce H2O ;
- Apparition de l’espèce H2O.
La recette de la grand-mère est une bonne recette pour faire baisser l’acidité de la sauce tomate. On considèrera que la sauce tomate se comporte comme une solution aqueuse. L’acidité d’une solution aqueuse est liée à la présence des ions H+. Plus leur nombre est important, plus la solution est acide. A partir des informations données dans l’ensemble du sujet, expliquer pourquoi la recette de la grand-mère de Bastien est une bonne recette pour diminuer l’acidité de la sauce tomate.
Exemple de TP sur les mélanges : l'hydrodistillation
Manipulations à effectuer
Première étape : l'hydrodistillation
- Placer quelques grains de pierre ponce au fond du ballon qui permettront la régulation des bulles de vapeur ;
- Placer les zestes d'orange dans le ballon ;
- Ajouter 100 mL d'eau ;
- Placer une éprouvette graduée ou un bécher pour recueillir le distillat à la sortie du réfrigérant ;
- Lever la plaque chauffante à l'aide du support élévateur pour qu'elle soit en contact avec le fond du ballon ;
- Faire circuler l'eau doucement dans le réfrigérant ; mettre en marche le chauffage ;
- Maintenir un chauffage modéré pendant environ 30 minutes ;
- Contrôler la température des vapeurs sortant du ballon ;
- Au bout de 30 min., ou dès que la température des vapeurs se stabilise à 100 °C arrêter le chauffage et baisser la plaque chauffante à l'aide du support élévateur ;
- Laisser l'eau du réfrigérant couler jusqu'à ce qu'il n'y ait plus de distillat qui goutte.
Deuxième étape : l'extraction de l'huile essentielle
- Introduire le distillat dans l'ampoule à décanter ;
- Ajouter 10 mL de solution aqueuse saturée en chlorure de sodium ;
- A l'aide de la burette graduée, prélever 5 mL de dichlorométhane et l'ajouter dans l'ampoule à décanter ;
- Remarquer la position de la phase organique ;
- Agiter en dégazant dans la hotte plusieurs fois ;
- Reposer l'ampoule sur son support et noter le résultat de l'observation ;
- Couler la phase inférieure (phase organique) dans un petit erlenmeyer bouché de 50 mL ;
- Ajouter 1 ou 2 grains de pierre de chlorure de calcium (CaCl2) ; c’est un déshydratant qui permet d’éliminer les traces d’eau de cette phase organique.
Troisième étape : Analyse du produit récupéré
- Verser l’éluant (cyclohexane) dans la cuve d’élution sur une hauteur inférieure à 1 cm ;
- Couvrir la cuve. Elle se remplit alors de vapeurs d'éluant ;
- Préparer la plaque comme dans le TP de CCM précédent (ligne de dépôts à 1 cm du bord inférieur) ;
- Y placer 2 croix que l’on notera E (pour la solution d’Extrait) et R (pour la solution de Référence) ;
- Déposer sur les croix, à l'aide de capillaires, les 2 solutions suivantes : solution de référence de limonène (R) et solution extraite de l'écorce d'orange contenue dans le petit erlenmeyer (E) ;
- Disposer la plaque dans la cuve et couvrir ;
- Laisser migrer jusqu'à ce que le front de l'éluant arrive à 1 cm du bord supérieur de la plaque ;
- Sortir la plaque et marquer rapidement le front de solvant d’un trait de crayon ;
- Sécher la plaque au sèche-cheveux, sous la hotte.
Révélation
- Pulvériser la plaque avec une solution aqueuse de permanganate de potassium (KMnO4) ;
- Sécher la plaque au sèche-cheveux ;
- Entourer délicatement les taches d’un trait de crayon.
Questions sur le TP
- Dessiner le montage de l'hydrodistillation et le légender ; faire apparaître les mots : Thermomètre, Ballon, Chauffe-ballon (ou plaque chauffante), Mélange à distiller, Support élévateur (ou boy), Sortie d'eau, Arrivée d'eau froide, Vapeurs, Pierre ponce, Condenseur (ou réfrigérant), Distillat (ou condensat), Phase organique, Phase aqueuse.
- Donner le rôle de la pierre ponce.
- Justifier le terme d'hydrodistillation.
- Quelle est l'odeur du produit obtenu ?
- Dessiner l'ampoule à décanter après brassage des 2 phases et décantation ; légender le schéma en faisant apparaître la phase organique et la phase aqueuse.
- Quelles sont les espèces chimiques présentes dans la phase organique ?
- Quelles sont les espèces chimiques présentes dans la phase aqueuse ?
- Justifier la position de la phase organique.
- En quoi consiste le relargage ? Quel en est l'intérêt ?
- Expliquer pourquoi il est nécessaire de faire une révélation.
- Schématiser ou coller la plaque en indiquant les différentes taches.
- Conclure.
Correction des questions
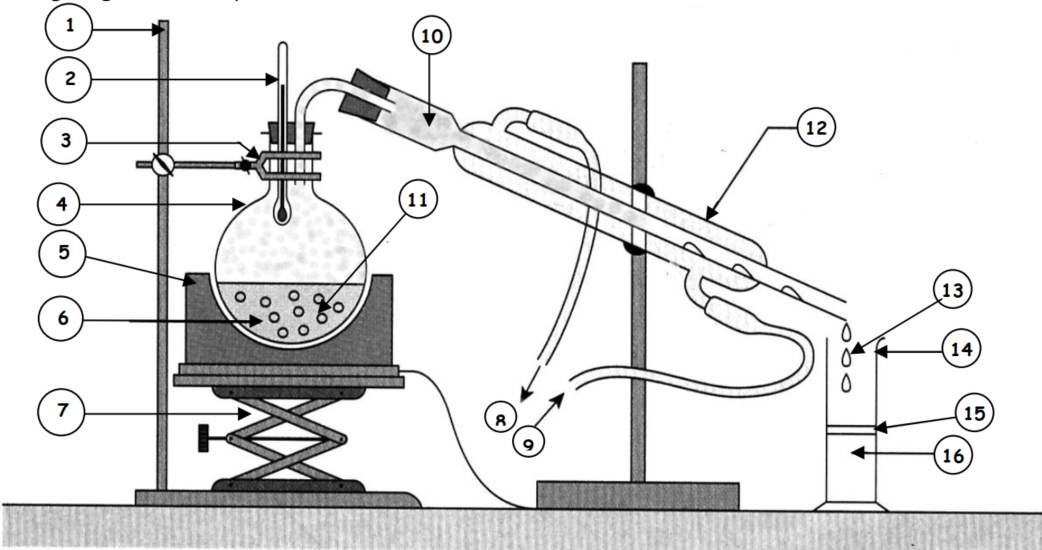
| Nom | Numéro |
|---|---|
| Potence | 1 |
| Thermomètre | 2 |
| Pince | 3 |
| Ballon | 4 |
| Chauffe-ballon | 5 |
| Mélange à distiller | 6 |
| Support élévateur | 7 |
| Sortie d'eau | 8 |
| Arrivée d'eau froide | 9 |
| Vapeurs | 10 |
| Pierre ponce | 11 |
| Condenseur | 12 |
| Distillat | 13 |
| Eprouvette | 14 |
| Phase supérieure | 15 |
| Phase inférieure | 16 |
- Donner le rôle de la pierre ponce : elle permet la régulation de l’ébullition par la formation de bulles de vapeur de petits diamètres ;
- Justifier le terme d'hydrodistillation : distillation (ébullition d’un mélange liquide et récupération d’un distillat liquide après condensation des vapeurs) pratiquée avec l’eau comme principal composant ;
- Quelle est l'odeur du produit obtenu ? Une odeur d'orange.
Schéma de l'ampoule à décanter : 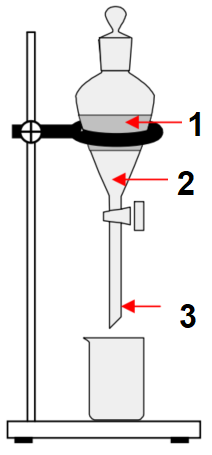
| Nom | Numéro |
|---|---|
| Phase aqueuse | 1 |
| Phase organique | 2 |
| Ampoule à décanter | 3 |
- Quelles sont les espèces chimiques présentes dans la phase organique ? dichlorométhane et limonène ;
- Quelles sont les espèces chimiques présentes dans la phase aqueuse ? eau, chlorure de sodium et très peu de limonène ;
- Justifier la position de la phase organique. La phase organique est essentiellement composée de dichlorométhane de densité 1,33 supérieure à celle de l’eau salée (deau salée saturée = 1,2) ; cette phase est donc la phase inférieure ;
- En quoi consiste le relargage ? ajouter du sel dans la phase aqueuse ;
- Quel en est l'intérêt ? permettre une plus faible solubilité du soluté à extraire et du solvant organique dans la phase aqueuse (les molécules d’eau « relâchent » les molécules de soluté et de solvant pour « s’occuper » des ions composant le sel) ; on obtient un meilleur rendement d’extraction (plus de soluté dans la phase organique).
- Expliquer pourquoi il est nécessaire de faire une révélation. Le limonène est une espèce incolore ; après avoir migré sur la plaque, les espèces restent invisibles, il faut donc les faire apparaître à l’aide d’un colorant ou d’un réactif coloré ou sous une lampe UV … dans notre cas nous avons utilisé une solution de permanganate de potassium ;
- Schématiser ou coller la plaque en indiquant les différentes taches ;
- Conclure. La solution de référence ne contenait que du limonène et du dichlorométhane (soluble dans le cyclohexane). Nous observons 2 taches dont les centres sont à la même hauteur par rapport à la ligne de dépôts, nous pouvons conclure qu’il y a bien présence de limonène dans le dépôt d’extrait.






















Si vous désirez une aide personnalisée, contactez dès maintenant l’un de nos professeurs !
Merci pour les exercices
Ça m’as beaucoup aidé