Chapitres

Introduction
Il faut aborder ce chapitre et le suivant en ayant pour objectif de comprendre que l'on peut contrôler les transformations chimiques. C'est-à-dire qu'il est possible d'agir sur une transformation de façon à modifier sa vitesse ou la composition du système à l'équilibre.
Ester

Groupe caractéristique
Le groupe caractéristique ester est ![]()
Formule générale d'un ester
La formule générale d'un ester est ![]() en notant que R correspond à un atome d'hydrogène ou une chaîne carbonée et que R' correspond à une chaîne carbonée.
en notant que R correspond à un atome d'hydrogène ou une chaîne carbonée et que R' correspond à une chaîne carbonée.
Nomenclature
Un ester est le produit de la réaction entre un acide carboxylique et un alcool. On retrouve donc dans la formule d'un ester un groupe d'atomes venant de l'acide carboxylique (groupe carboxylate: R—COO—) et un groupe alkyle R'— venant de l'alcool R'—OH. Un ester se présente donc comme un carboxylate d'alkyle. La nomenclature des esters est déduite de cette analyse.
Exemple:
| Ester | Acide | Alcool | Nom de l'ester |
|---|---|---|---|
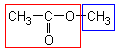 | 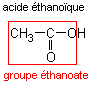 | 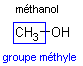 | éthanoate de méthyle |
de la même façon, C6H5—COO—C2H5 est le benzoate d'éthyle
Propriétés des esters
En physique chimie cours, les esters sont en général liquides (à pression et température usuelles), assez volatils, à odeur fruitée et très peu solubles dans l'eau (contrairement aux acides et aux alcools dont ils dérivent).
Rappel : les alcools

Les alcools sont identifiables grâce à la fonction organique alcool. Elle consiste en un groupe -OH lié à l'un des carbones de la chaîne carbonée d'un alcane. En réalité, il y a trois classes d'alcools. On les distingue en fonction du nombre de groupes alkyles auxquels il est lié
Lorsque l'alcool est la fonction principale de la molécule que l'on cherche à nommer, il suffit alors de remplacer la voyelle terminale « e » de l'alcane correspondant à l'alcool que l'on cherche à nommer par le suffixe -ol. Il est ensuite nécessaire d'indiquer le numéro de l'atome de carbone où le groupe hydroxyle est fixé. Même si cette précision n'est pas toujours nécessaire, il est alors possible d'omettre cette précision pour une lecture plus digeste. Si la fonction alcool n'est pas la fonction principale de la molécule, il faut alors ajouter le préfixe hydroxy- précédé du numéro de l'atome de carbone où le groupe est fixé. Ensuite, pour nommer la base conjuguée de l'alcool, comme l'ion alcoolate, il suffit simplement de remplacer la voyelle terminale « e » par le suffixe -olate. Veillez à ne pas confondre avec le suffixe -oate qui est plutôt caractéristique du carboxylate, correspondant alors base conjuguée de l'acide carboxylique.
Où trouver des cours de physique en ligne ?
Exemple de l'éthanol
L'éthanol, également appelé alcool éthylique, correspond à un alcool dont la formule semi-développée est CH3-CH2-OH. L'éthanol est un liquide incolore, volatil, miscible à l'eau en toutes proportion et inflammable en plus d'avoir des propriétés psychotropes très connue car l'éthanol correspond à la drogue récréative la plus ancienne lorsqu'il est sous la forme de boissons alcoolisées. Cette molécule est très utilisée par l'industrie agroalimentaire afin de produire des spiritueux mais également par la parfumerie et la pharmacie galénique qui utilise l'éthanol comme solvant. Aujourd'hui, l'éthanol est également très utilisé sous la forme de bioéthanol afin de s'en servir comme biocarburant. Vous pouvez également le retrouver dans les thermomètres à alcool.
Besoin de cours physique chimie college ?
Estérification et hydrolyse de l'ester
Equation de la réaction
L'estérification est la réaction qui permet d'obtenir un ester. On peut, pour cela faire réagir un acide carboxylique R—COOH avec un alcool R'—OH. Cette réaction conduit à un ester R—COO—R' et de l'eau suivant l'équation:
R—COOH + R'—OH = R—COO—R' + H2O
La réaction en sens inverse entre l'ester et l'eau qui conduit à un alcool et à un acide carboxylique est appelée hydrolyse de l'ester et se produit simultanément.
Propriétés des réactions d'estérification et d'hydrolyse de l'ester
Ces deux réactions sont:
- lentes,
- limitées par leur réaction inverse (l'estérification est limitée par l'hydrolyse de l'ester formé),
- athermiques. Elles ne nécessitent pas d'apport d'énergie thermique (chaleur) pour se produire et ne dégagent pas d'énergie thermique. Ce qui ne signifie pas qu'un apport d'énergie thermique soit sans effet sur ces transformations comme nous le verrons plus loin.
Méthode expérimentale permettant de suivre l'évolution de la transformation

Pour suivre l'évolution de ces transformations on dose à des dates t l'acide présent dans le milieu réactionnel (voir le TP "limite de l'estérification"). La connaissance des quantités de matière d'acide initiale et à l'instant t permet de déterminer le taux d'avancement de la réaction.
Pour l'estérification, considérons l'exemple d'un mélange équimolaire d'acide éthanoïque et d'éthanol (alcool primaire). Le tableau d'avancement est:
| Équation de la réaction | RCOOH + ROH = RCOOR' + H20 | |||
|---|---|---|---|---|
| E.I (mol) | n0 | n0 | n(est) 0 = 0 | n(H2O) 0 = 0 |
| E.t (mol) l'avancement est x | n(ac) f = n0 - x | n(al) f = n0 - x | n(est) 0 = x | n(H2O) 0 = x |
| E.E (mol) l'avancement est xf | n(ac) f = n0 - xf | n(al) f = n0 - xf | n(est) 0 = xf | n(H2O) 0 = xf |
On a donc x = n0 - n(ac). La quantité de matière d'acide à la date t est déterminée par dosage d'un échantillon du milieu réactionnel.
xmax = n0.
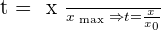
l'allure de la courbe t=f(t) est donné ci-dessous.

Etat d'équilibre
Point de vue cinétique
L'état d'équilibre est la situation pour laquelle la vitesse de la réaction d'estérification est la même que la vitesse d'hydrolyse de l'ester formé. Les quatre espèces (acide, alcool, ester et eau) coexistent.
Quotient de réaction et constante d'équilibre
Le quotient de réaction Qr s'écrit : 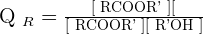
La constante d'équilibre K s'écrit : 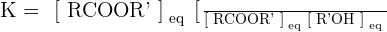 ou encore
ou encore 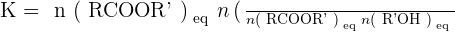
On remarquera que, dans ce cas particulier, l'eau figure dans les expressions de Qr et de K. Cela tient au fait que l'eau n'est pas considérée ici comme le solvant mais comme un simple produit de l'estérification ou un simple réactif de l'hydrolyse de l'ester.
Besoin d'un professeur physique ?
Influence de certains facteurs sur les réactions d'estérification et d'hydrolyse des esters
Introduction
Ces facteurs peuvent modifier la vitesse de réaction ou la composition du milieu réactionnel à l'équilibre.
Influence de la température
Sur le taux d'avancement final (composition à l'équilibre)

Une modification de la température du milieu réactionnel est sans influence sur le taux d'avancement final. Cela est du au fait que ces réactions sont athermiques. Cela signifie aussi que la constante d'équilibre est indépendante de la température, contrairement à ce qui est observé pour la grande majorité des autres transformations.
Sur la cinétique des transformations
Qu'il s'agisse de l'estérification ou de l'hydrolyse d'un ester, une élévation de la température du milieu réactionnel augmente la vitesse de réaction. Cela signifie que l'équilibre est atteint plus rapidement (sans que la composition à l'équilibre soit modifiée).
Influence d'un catalyseur
Définition d'un catalyseur
Un catalyseur est une espèce chimique, introduite dans le milieu réactionnel, qui a pour effet d'augmenter la vitesse de réaction sans figurer dans l'équation de la réaction (voir dernier chapitre: la catalyse).
Catalyse des réactions d'estérification et d'hydrolyse de l'ester
Les ions oxonium (H3O+ ou plus simplement H+) catalysent aussi bien la réaction d'estérification que la réaction inverse. Ils sont fréquemment introduits dans le milieu réactionnel par l'acide sulfurique ou l'acide paratoluènesulfonique.
Ce catalyseur permet d'atteindre plus rapidement l'état d'équilibre sans changer la composition du milieu réactionnel à l'équilibre.
Rappel : les ions oxonium et le pH
Le pH, ou encore potentiel hydrogène, correspond à une mesure de l'activité chimique de ce qu'on appelle les hydrons dans une solution. Mais vous les connaissez plus certainement sous le nom de protons ou encore ions hydrogènes. De façon plus particulière, ces protons, dans une solution aqueuse, se présentent sous la forme de l'ion hydronium qui représente le plus simple des ions oxonium. Le pH est, le plus souvent, utilisé afin de mesurer l'acidité ou encore la basicité de la solution. On peut alors la déterminer avec l'échelle suivante dans le cas d'un milieu aqueux à 25°C :
- Une solution de pH égal à 7 est considérée comme étant neutre ;
- Une solution de pH inférieur à 7 est considérée comme étant acide. De ce fait, plus son pH diminue, plus elle est acide ;
- Une solution de pH supérieur à 7 est considérée comme étant basique. De ce fait, plus son pH augmente, plus elle est basique.
Mais la définition que nous connaissons aujourd'hui du pH, définition de Sorensen, n'a été officiellement reconnue qu'à partir du milieu du XXe siècle par l'UICPA :
L’UICPA, l’Union Internationale de Chimie Pure et Appliquée est une organisation non gouvernementale ayant son siège à Zurich, en Suisse. Créée en 1919, elle s’intéresse au progrès de la chimie, de la chimie physique et de la biochimie. Ses membres sont les différentes sociétés nationales de chimie et elle est membre du Conseil International pour la Science. L’UICPA est une autorité reconnue dans le développement des règles à adopter pour la nomenclature, les symboles et autres terminologies des éléments chimiques et leurs dérivés via son Comité Interdivisionnel de la Nomenclature et des Symboles. Ce comité fixe la nomenclature de l’UICPA.
Cette définition est donc celle que nous retrouvons dans les manuels scolaires et s'énonce ainsi : 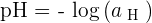 Avec aH, également noté aH+ ou [H+], qui correspond à l'activité des ions hydrogène H+. aH correspond donc à une grandeur sans dimension tout comme le pH.
Avec aH, également noté aH+ ou [H+], qui correspond à l'activité des ions hydrogène H+. aH correspond donc à une grandeur sans dimension tout comme le pH.
Néanmoins, cette définition ne nous permet pas d'obtenir des mesures directes du pH ni même des calculs. En effet, le pH dépend uniquement de l'activité des ions hydrogènes. De ce fait, le pH dépend de plusieurs autres facteurs découlant de cette activité. On peut par exemple parler de l'influence du solvant ou encore de la température. Il reste cependant possible d'obtenir des valeurs approchées du pH en utilisant ce calcul. Pour cela, il est nécessaire de faire appel à des définitions de l'activité. Cette définition formelle ne permet pas des mesures directes de pH, ni même des calculs. Le fait que le pH dépende de l’activité des ions hydrogène induit que le pH dépend de plusieurs autres facteurs, tels que l’influence du solvant. Toutefois, il est possible d’obtenir des valeurs approchées de pH par le calcul, à l’aide de définitions plus ou moins exactes de l’activité.
Remarque : Le p de pH représente la fonction "- log" donc ici - log (H). Donc si on parle de pOH ou de pKa, cela signifie que l'on parle de - log (OH) et de - log (Ka).
Nouvelle définition du pH
Aujourd'hui, une autre définition du pH a été donné par l'UICPA. Cette définition, déterminée grâce à une méthode électrochimique expérimentale, consiste à utiliser la relation de Nernst dans une cellule électrochimique définie comme qui suit : Électrode de référence | Solution de KCl concentré | Solution X | H2 | Pt (électrode à hydrogène) Ainsi, via des mesures de ce qu'on appelle force électromotrice, également notée fem ou f.e.m., de la cellule avec une solution de référence notée S, on peut obtenir la relation suivante : 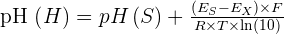 Avec :
Avec :
- pH(X) représentant le pH de la solution inconnue ;
- pH(S) représentant le pH tabulé de la solution de référence S ;
- EX représentant la f.e.m. de la cellule avec la solution inconnue X ;
- ES représentant la f.e.m. de la cellule avec la solution de référence S à la place de la solution X ;
- F = 96 485 C mol−1 représentant la constante de Faraday ;
- R = 8,314 472 J mol−1 représentant la constante universelle des gaz parfaits ;
- Et T représentant la température absolue, en kelvins.
Où trouver des cours physique chimie ts ?
Autres rappels
La théorie VSEPR
La théorie VSEPR , signifiant en Anglais Valence Shell Electron Pair Repulsion, encore noté RPECV en Français, signifie « répulsion des paires électroniques de la couche de valence ». Cette théorie correspond à une méthode destinée à prédire la géométrie des molécules. Cela est possible en se basant sur la théorie de la répulsion des électrons de la couche de valence, également connue sous le nom de « théorie de Gillespie »
Prérequis et supposition
La méthode VSEPR est fondée sur un certain nombre de suppositions qui concernent principalement la nature des liaisons entre atomes :
- les atomes dans une molécule sont liés par des paires d'électrons ;
- deux atomes peuvent être liés par plus d'une paire d'électrons. On parle alors de liaisons multiples ;
- certains atomes peuvent aussi posséder des paires d'électrons qui ne sont pas impliqués dans une liaison. On parle de doublets non liants ;
- les électrons composant ces doublets liants ou non liants exercent les uns sur les autres des forces électriques répulsives. Les doublets sont donc disposés autour de chaque atome de façon à minimiser les valeurs de ces forces ;
- les doublets non liants occupent plus de place que les doublets liants ;
- les liaisons multiples prennent plus de place que les liaisons simples.
Notation
Dans la théorie VSEPR, il y a certains usages de notation à respecter :
- On note l'atome central de la molécule étudiée A.
- Les doublets non-liants, et donc les paires d'électrons appartenant à l'atome central A qui se sont pas impliqués dans les liaisons sont notés E et m leur nombre.
- Les doublets liants, et donc paires d'électrons qui sont impliqués dans des liaisons entre l'atome central A et un autre atome sont notés X. Le nombre de doublets liants sera noté n.
Les molécules simples, dont la géométrie est facilement définissable grâce à la méthode VSEPR sont donc notés suivant la notation vu ci-dessus et se présentent donc sous la forme : AXnEm
Formation d'une molécule : la liaison covalente
Définition
Une liaison covalente entre deux atomes correspond à la mise en commun entre ces deux atomes de deux électrons de leurs couches externes pour former un doublet d'électrons appelé doublet liant.
Le doublet liant, mis en commun entre les deux atomes, est considéré comme appartenant à chacun des atomes liés.
Nombre de liaisons covalentes établies par un atome
Le nombre de liaisons covalentes que peut former un atome est égal au nombre d'électrons qu'il doit acquérir pour saturer sa couche externe à un octet d'électrons (ou un duet pour l'atome d'hydrogène).
Les forces de Van Der Waals
Nommées ainsi en l'honneur de Johannes Diderik van der Waals, un physicien néerlandais du XIX ème siècle, ces forces peuvent se décrire comme les interactions électroniques entres les atomes ou molécules, qui les lient ensemble.
Johannes Diderik van der Waals fut le premier a les prendre en compte dans es calculs en 1873. Cela lui valut de recevoir en 1910 le prix Nobel de physique.
Un prix Nobel, Nobelpriset de son nom original en suédois, est une récompense au niveau mondial qui gratifie son détenteur d’être l’une des personne ayant apporté le plus grand bénéfice à l’humanité. C’est un prix qui se remet tous les ans.Le premier a été remis en 1901. Ils récompensent des découvertes ou un travail en faveur de la paix.
Il en existe 5 : le prix Nobel de physique, le prix Nobel de chimie, le prix Nobel de la paix, le prix Nobel de médecine et de physiologie et le prix Nobel de littérature.
Ce phénomène s'explique par la répartition des charges au sein d'une molécule ou au sein des couples d'atomes. Pour plus de détails, il faut néanmoins se plonger dans la physique quantique pour en comprendre les principes les plus poussés.
On peut leur trouver trois origines :
- L'interaction électrostatique attractive entre deux multipôles induits, il s'agira dans ce cas des forces de London ;
- L'interaction attractive entre un multipôle permanent et un multipôle induit et il s'agira des forces de Debye ;
- L'interaction électrostatique attractive ou répulsive entre deux multipôles permanents selon leurs orientations, il s'agit alors des forces de Keesom.
Les exemples les plus flagrants des effets des forces de Van Der Waals sont les absorptions par capillarité ainsi que les systèmes d'accroche des pattes de gecko qui peuvent coller aux murs.
La polarisation
Électronégativité des atomes
Dans le domaine de la chimie, on décrit l'électronégativité comme étant une grandeur physique caractérisant la capacité d'un atome à attirer un ou plusieurs électrons lors de la formation d'une liaison chimique avec une autre espèce.
Selon leur configuration électronique, certains atomes capteront les électrons facilement alors que d'autres n'y arriveront pas. Par exemple, l'atome de fluor a pour configuration k2l7, il gagnera facilement un électron pour saturer la couche l.
La facilité des atomes à capter un électron s'appelle l'électronégativité. Dans le tableau périodique, les atomes les plus électronégatifs se trouvent en haut à droite.
Polarité d'une liaison chimique
Lorsque deux atomes sont liés chimiquement, c'est qu'ils mettent en commun deux électrons. Les deux électrons sont alors en orbite autour des deux noyaux, ils forment alors la liaison.
Dans le cas de deux atomes identiques, le doublet est également partagé et symétrique par rapport à l'axe de liaison.
Dans le cas où, les deux atomes sont différents, celui qui est le plus électronégatif attire plus fortement le doublet. Le nuage électronique est alors plus dense du côté de l'atome le plus électronégatif et crée une charge négative à cet endroit et positive sur l'autre atome. Une telle molécule possède deux pôles électriques, on dit qu'elle est polarisée.























Si vous désirez une aide personnalisée, contactez dès maintenant l’un de nos professeurs !