Chapitres
- 01. Exercice n°1
- 02. Exercice n°2
- 03. Exercice n°3
- 04. Exercice n° 4
- 05. Exercice n°5
- 06. Exercice n°6
- 07. Exercice n°7
- 08. Exercice n° 8
- 09. Exercice 9
- 10. Exercice 10
- 11. Exercice 10

Exercice n°1
Un détergent liquide est soumis à des tests chimiques. Les résultats de ces tests sont regroupés dans le tableau suivant :
| Tests | Résultats |
|---|---|
| Sulfate de cuivre anhydre | Bleu foncé |
| Papier pH | Le papier rougit |
| Liqueur de Fehling | Bleu |
- Le test au sulfate de cuivre anhydre est-il positif ou négatif?
- Le test à la liqueur de Fehling est-il positif ou négatif? Faire un schéma annoté de l'expérience
- Quelles informations peut-on tirer de ces tests?
Données : papier pH rouge donc pH = 2

Exercice n°2
La photographie de l'étiquette d'une margarine est donnée ci-dessous.

- Citer trois ingrédients naturels présents dans cette margarine.
- Citer un ingrédient synthétique présent dans cette margarine.
- Citer une autre huile végétale naturelle que celles qui sont annoncées par l'étiquette.
- Quel est le rôle d'un conservateur?
Exercice n°3
On désire extraire le diiode de l'eau iodée. La solubilité du diiode dans différents solvants est donnée dans le tableau suivant :
| Solvant | Eau | Alcool | Éther | Benzène |
|---|---|---|---|---|
| Solubilité (g.L-1) | 0,3 | 250 | 250 | 140 |
| Densité | 1 | 0,81 | 0,7 | 1,5 |
On dispose en outre des informations suivantes :
- L'alcool est miscible à l'eau ;
- L'éther et le benzène ne sont pas miscibles à l'eau.
- Quel solvant vaut-il mieux choisir pour extraire le diiode de l'eau iodée? Justifier la réponse.
- Dresser le protocole de cette extraction.
Vous cherchez un professeur physique chimie ?
Exercice n° 4
On réalise la chromatographie de trois encres. Une encre verte, notée V, une encre violette, notée Vi et une encre noire, notée N. Le chromatogramme obtenu est donné ci-contre.
- En analysant le chromatogramme que pouvez-vous dire sur les encres testées? Une analyse la plus complète possible est attendue. Elle devra faire apparaître les mots ou expressions:
- Corps pur ;
- Corps composé ;
- Corps pur(s) commun(s).
- Déterminer les rapports frontaux des taches : bleu, jaune, violet et rouge.

Exercice n°5
Identifier les dangers représentés par les pictogrammes suivants et indiquer les précautions à prendre avec ces produits. 
Exercice n°6
L'étiquette collée sur une bouteille de shampoing nous informe qu'il contient, entre autres, de l'eau et un acide carboxylique. Proposer et décrire des tests qui permettraient de confirmer la présence de ces deux espèces.

Exercice n°7
Un alambic à feu nu, schématisé ci-dessous, est un dispositif encore utilisé de nos jours dans certaines régions pour extraire l'essence de lavande.

- Expliquer le rôle du feu dans ce dispositif.
- Expliquer le rôle du serpentin. En particulier expliquer pourquoi il n'est pas droit.
- L'essencier contient un mélange d'essence de lavande (densité = d = 0,75) et d'eau. Ces deux liquides sont non miscibles. Où se situe l'essence de lavande dans l'essencier ?
- Quel nom donne-t-on à cette technique d'extraction ?
- Légender le schéma du dispositif équivalent utilisé en travaux pratiques.

Exercice n° 8
On analyse par chromatographie sur couche mince l'huile essentielle de lavande. On a obtenu le chromatogramme ci-contre avec les produits suivants:
- A : huile essentielle de lavande ;
- B : linalol ;
- C : acétate de linalyle.
- A partir du chromatogramme, dire, en justifiant la réponse quels sont le(s) produit(s) pur(s) et le(s) produit(s) composé(s).
- Quelles molécules peuvent être identifiées dans l'huile essentielle de lavande? justifier la réponse.

Exercice 9
L'AOSEPT était commercialisé il y a quelques années chez les opticiens et les pharmaciens pour le nettoyage et la décontamination des lentilles de contact.

Ce produit comprend une solution aqueuse et un étui porte-lentilles muni d'un disque catalytique.
Le disque catalytique est constitué d'un support en plastique sur lequel a été déposée une fine couche de platine.
La notice du produit indique que la solution aqueuse contient, entre autres, du peroxyde d'hydrogène
ou eau oxygénée à 3% en masse et du chlorure de sodium (0,85 g pour 100 mL de solution).
1. Disque catalytique
La décontamination des lentilles a lieu à l'intérieur de I’étui contenant le disque, dans lequel
l’utilisateur doit préalablement verser un peu de la solution d’AOSEPT. Dans cet étui, se produit la décomposition de l’eau oxygénée en dioxygène et en eau, catalysée par le platine.
1.1. Définir le terme « catalyseur ».
1.2. Pourquoi qualifie-t-on cette catalyse d’hétérogène ?
1.3. On donne les couples oxydant/réducteur mis en jeu : H2O2 (aq) / H2O () et O2 (g) / H2O2 (aq).
Écrire les deux demi-équations électroniques associées à ces couples.
En déduire l’équation de la réaction de décomposition de l’eau oxygénée.
2. Dosages des ions chlorure Cl–(aq)
Les ions chlorure apportés par le chlorure de sodium sont dosés selon deux méthodes; les deux
modes opératoires correspondants sont décrits ci-dessous.
Toutes les mesures sont effectuées à 25°C.
Premier mode opératoire.
- À l’aide d'une solution S0 de chlorure de sodium de concentration molaire en soluté
apporté 1,0 × 10–1 mol∙L–1, on prépare des solutions diluées de concentrations c décroissantes : 5,0 × 10 –2 mol∙L–1 ; 2,5 × 10 –2 mol∙L–1 ; 1,0 × 10 –2 mol∙L–1 ; 5,0 × 10 –3 mol∙L–1 ;
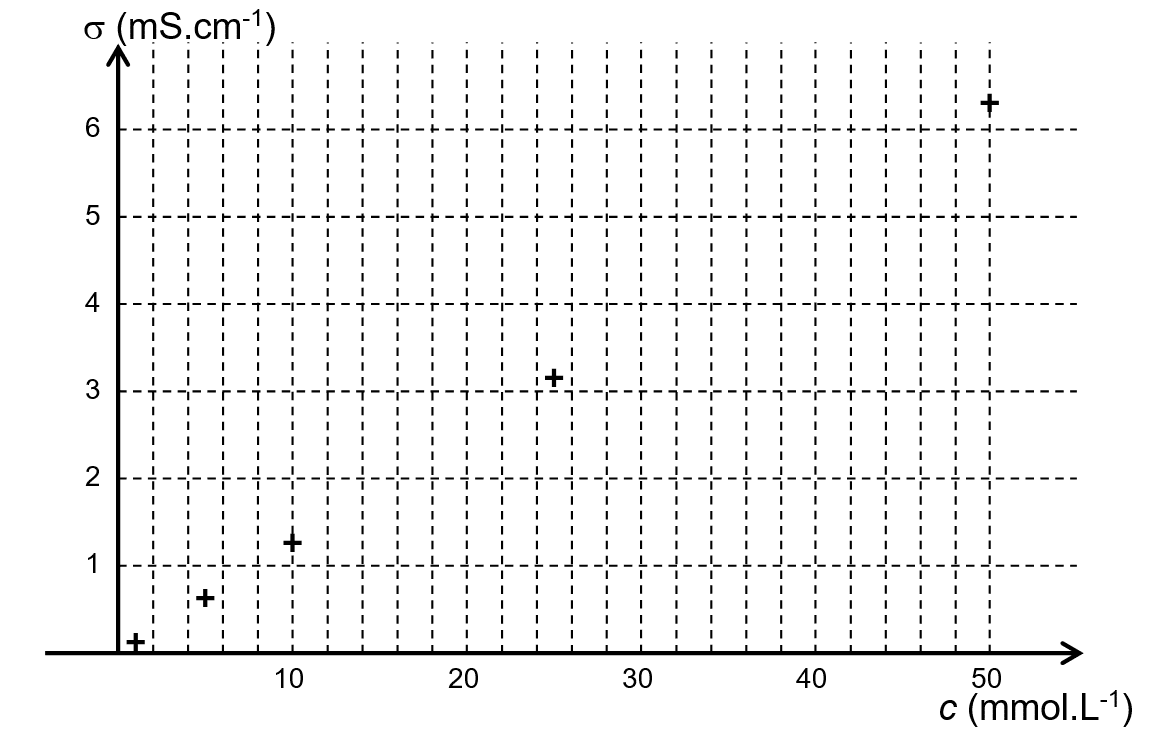
1,0 × 10 –3 mol∙L–1. - On mesure la conductivité de la solution S0 et celle des solutions diluées en plongeant dans chaque solution la même cellule de conductimétrie
LA FIGURE 1 DE L'ANNEXE représente les valeurs de conductivité σ pour les
différentes concentrations c.
- On dilue dix fois la solution commerciale d’AOSEPT; on note S la solution diluée. On plonge ensuite la même cellule de conductimétrie dans S ; la conductivité mesurée est égale à 1,8 mS.cm –1.
Deuxième mode opératoire.
- Dans un bécher, on introduit un volume V1 = 10,0 mL de solution de nitrate d'argent (Ag+(aq)+ NO3–(aq)) de concentration molaire c1 = 1,0 × 10 –1 mol∙L–1 et 90 mL d'eau distillée.
- On plonge la cellule de conductimétrie dans la solution de nitrate d'argent obtenue.
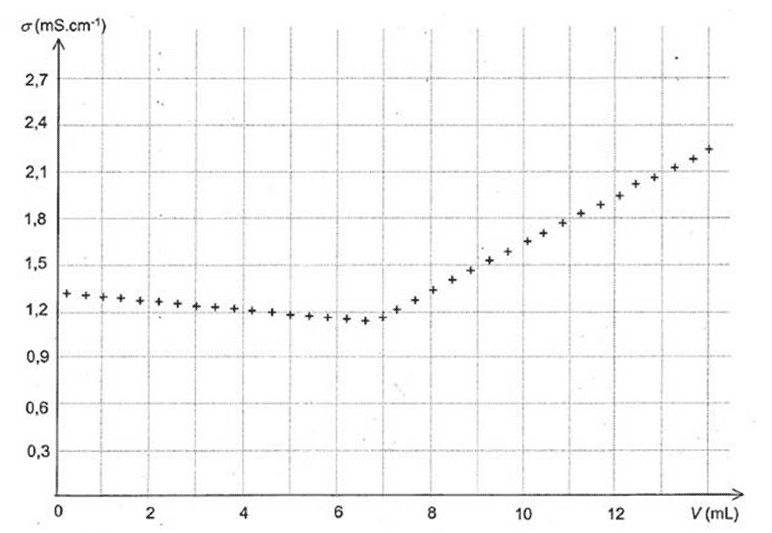
- On ajoute à l’aide d'une burette graduée mL par mL, la solution commerciale d’AOSEPT, en notant à chaque ajout la conductivité s de la solution. On obtient un précipité blanc de chlorure d'argent.
LA FIGURE 2 DE L'ANNEXE représente les valeurs de conductivité s pour les différents volumes V de la solution commerciale d’AOSEPT versés.
2.1. On distingue les dosages par étalonnage et par titrage. Associer à quel type de dosage
correspond chacun des deux modes opératoires utilisés.
2.2. Exploitation de la première méthode
2.2.1. Déterminer la concentration molaire du chlorure de sodium dans la solution diluée S puis dans la solution commerciale d’AOSEPT en expliquant comment sont exploités les résultats expérimentaux donnés SUR LA FIGURE 1 DE L'ANNEXE.
2.2.2. En déduire la concentration massique du chlorure de sodium notée cm1 dans la solution commerciale.
Données :
- M (Na) = 23,0 g.mol –1
- M (Cl) = 35,5 g.mol –1
2.3. Exploitation de la deuxième méthode
2.3.1. Écrire l’équation associée à la réaction modélisant la transformation qui se produit dans
le deuxième mode opératoire.
2.3.2. À l’aide de LA FIGURE 2 DE L'ANNEXE, déterminer le volume à l’équivalence VE. Expliquer la démarche suivie.
2.3.3. Indiquer, sans justification, parmi les espèces ioniques suivantes NO3–, Na+, Ag+ et Cl –, celles qui sont présentes dans la solution :
– pour un volume V versé inférieur au volume versé à l’équivalence VE
– pour un volume V versé supérieur au volume versé à l’équivalence VE
2.3.4. On rappelle l’expression de la conductivité s en fonction des concentrations molaires effectives [ Xi ] des espèces ioniques Xi en solution : [sigma = sum_i lambda_{i} [X_{i}]] où λi est la conductivité molaire ionique des ions Xi.
Données :
Conductivités molaires ioniques λ des ions présents dans cette expérience :
| Ions | λ (en S.m2.mol –1) à 25°C |
|---|---|
| Ag+ | 6,19 × 10 –3 |
| NO3- | 7,14 × 10 –3 |
| Na+ | 5,01 × 10 –3 |
| Cl- | 7,63 × 10 –3 |
On négligera la variation de volume de la solution dans le bécher lors de l’ajout de la solution d’AOSEPT.
À partir des expressions de la conductivité s de la solution (avant et après l’équivalence) et en comparant les valeurs des conductivités molaires ioniques du tableau ci-dessus, justifier brièvement :
– la décroissance de la conductivité s de la solution avant l’équivalence.
– l’augmentation de la conductivité s de la solution après l’équivalence.
2.3.5. Déterminer la concentration molaire c0 des ions chlorure dans la solution commerciale d’AOSEPT, en expliquant comment sont exploités les résultats expérimentaux. En déduire la concentration massique du chlorure de sodium notée cm2 dans la solution commerciale.
2.3.6. Pour un tel produit, on peut considérer que le contrôle de qualité est satisfaisant si l’écart relatif entre la mesure effectuée et l’indication du fabricant est inferieur à 10 %. Les deux résultats précédents, obtenus pour la concentration massique notée cm du chlorure de sodium dans la solution commerciale d’AOSEPT, correspondent-ils à ce critère ?
Annexes à rendre avec la copie
Exercice 10
L’électrolyse de sel est une des techniques utilisées dans le traitement des eaux d’une piscine. Cette technique permet d’éviter l’utilisation souvent excessive de produits chlorés pour le traitement de l’eau.
Un électrolyseur de sel pour piscine est constitué d’un boîtier électronique et d’une cellule d’électrolyse insérée dans le circuit de filtration. La cellule contient des électrodes de titane recouvertes de métaux précieux : ruthénium et iridium. Quand l’eau circule entre les électrodes aux bornes desquelles est appliquée une tension continue, un courant électrique continu s’établit et l’électrolyse du chlorure de sodium dissous (Na+(aq) + Cl–(aq)) se produit. De l’acide hypochloreux HClO(aq) (appelée chlore actif) est généré indirectement in situ. Cette espèce est particulièrement efficace pour désinfecter l’eau de la piscine.
1. Influence du pH de l'eau de piscine

Les quantités de dichlore et des formes acide ou basique de l’acide hypochloreux, en solution, sont fonction du pH de la solution. Ainsi, à 25°C, les proportions de ces espèces en fonction du pH sont données par les courbes de la figure 1.
Le pH d’une eau de piscine doit être compris entre 7,2 et 7,6 pour le confort de la baignade. Pour les deux bornes de cet intervalle de pH, estimer les proportions de chacune des espèces chimiques. Ces proportions correspondent-elles à une désinfection optimale ?
2. Dosage des ions chlorure
Pour que l’électrolyse soit efficace, l’eau de piscine doit contenir entre 3 et 5 grammes de sel par litre. Pour s’assurer du bon fonctionnement du système de désinfection de sa piscine, un chimiste prélève un échantillon d’eau de piscine qu’il va analyser dans son laboratoire. Il procède à un dosage conductimétrique des ions chlorure présents dans l’eau de piscine par les ions argent.
L’équation de la réaction support du titrage est la suivante :
Ag+(aq) + Cl–(aq) → AgCl(s)
Protocole du dosage :
- Remplir la burette graduée avec la solution aqueuse titrante de nitrate d’argent
(Ag+(aq) + NO3–(aq)) de concentration en soluté apporté c = 0,050 mol.L-1.
- Dans un bécher de 200 mL, introduire précisément 10,0 mL d’eau de piscine prélevée et ajouter 90 mL d’eau distillée.
- Placer, dans le bécher, la cellule conductimétrique reliée au conductimètre.
- Verser des volumes successifs de 2,0 mL de solution de nitrate d’argent dans le bécher en maintenant en permanence une agitation. Relever après chaque addition la conductivité σ de la solution obtenue et rassembler les résultats dans un tableau.
Données :
- Loi de Kohlrausch
La conductimétrie est une méthode d’analyse qui permet de mesurer la conductivité d’une solution, c’est-à-dire son aptitude à conduire le courant électrique.
La conductivité σ d’une solution ionique dépend de la nature des ions Xi présents dans la solution et de leur concentration molaire [Xi].
Ainsi, pour une solution ne contenant que des ions monochargés, notés X1, X2, X3 …, l’expression de la conductivité s’écrit :
σ = λ1.[X1] + λ2.[X2] + λ3.[X3] + … avec σ en S.m-1 ; λi (conductivité molaire de l’ion Xi) en S.m².mol-1 et [Xi] en mol.m-3.
| Ion | Na+ | Ag+ | Cl- | NO3- |
|---|---|---|---|---|
| λ (mS.m2.mol-1) | 5,01 | 6,19 | 7,63 | 7,14 |
- Masses molaires atomiques en g.mol–1: M(Cl) = 35,5 ; M(Na) = 23,0.
2.1. Schématiser et légender le montage expérimental réalisé pour effectuer le dosage conductimétrique.
2.2. Quelles verreries doit-on utiliser pour introduire dans le bécher les 10,0 mL d’eau de piscine à doser, puis les 90 mL d’eau distillée ? Justifier.
2.3. Donner l’expression de la conductivité σ du mélange avant l'équivalence, puis celle après l'équivalence.
2.4. Interpréter qualitativement les variations de la conductivité avant et après l’équivalence.
2.5. Donner l’allure de la courbe de titrage σ = f(VAg+) représentant la conductivité σ du mélange en fonction du volume de solution de nitrate d’argent versé et justifier la position du point d’équivalence sur cette courbe.
Le volume versé à l’équivalence est VE = 15,0 mL.
2.6. En explicitant votre démarche, déterminer la concentration molaire en ions chlorure de l’eau de piscine.
2.7. Est-il nécessaire de rajouter du sel dans la piscine ? Justifier.
Exercice 10
Le guarana est une liane originaire de la forêt amazonienne qui grimpe sur les arbres et produit des graines riches en caféine, théobromine, xantine, théophylline, oligo-éléments et vitamines.
Le guarana, utilisé dès l’époque précolombienne, est recommandé pour favoriser la concentration mentale, la mémoire et la vigilance.
Il est commercialisé sous différentes formes : graines, gélules, poudres, infusettes, comprimés, …
L’Agence européenne pour la sécurité des aliments (EFSA) a publié, le 27 mai 2015, une recommandation de dose journalière au-delà de laquelle la caféine peut présenter un risque pour la santé. Pour les adolescents, la dose journalière de caféine est fixée à 3 mg par kilogramme de masse corporelle.
L’objectif de cet exercice est de déterminer le nombre de gélules de guarana qui pourrait être consommé quotidiennement, sans risque pour la santé.
Pour déterminer la quantité de caféine contenue dans une gélule, on réalise les expériences suivantes :
- préparation d’une solution aqueuse S0 de caféine de concentration molaire 2,50 mmol.L-1;
- préparation de six solutions aqueuses à partir de la solution S0 ;
- mesure de l’absorbance de chacune des solutions filles après réglage du spectrophotomètre :
| Solution fille | S1 | S2 | S3 | S4 | S5 | S6 |
|---|---|---|---|---|---|---|
| Concentration molaire (mmol.L-1) | 2,50 x 10-2 | 5,00 x 10-2 | 7,50 x 10-2 | 1,00 x 10-1 | 1,25 x 10-1 | 1,50 x 10-1 |
| Absorbance | 0,230 | 0,452 | 0,3677 | 0,880 | 1,112 | 1,325 |
- dissolution d’une gélule de guarana dans 500 mL d’eau distillée. Le spectrophotomètre ne fournissant des mesures exploitables que pour des absorbances inférieures à 2, la solution obtenue, trop concentrée pour les mesures d’absorbance, à la même longueur d’onde, est diluée d’un facteur 10. L’absorbance de la solution diluée notée S est mesurée : A = 0,524.
Données : masses molaires atomiques
M(C) = 12,0 g.mol-1 ; M(H) = 1,0 g.mol-1 ; M(N) = 14,0 g.mol-1 ; M(O) = 16,0 g.mol-1.
1. La molécule de caféine
La formule topologique de la molécule de caféine est représentée ci-contre :

1.1. Représenter la formule semi-développée de la molécule de caféine.
1.2. Calculer sa masse molaire.
1.3. Combien de signaux doit-on observer sur le spectre RMN du proton de cette molécule ? Justifier.
1.4. Prévoir la multiplicité des différents signaux sur spectre RMN du proton de la caféine. Justifier.
Le spectre RMN du proton de la caféine est donné ci-dessous :
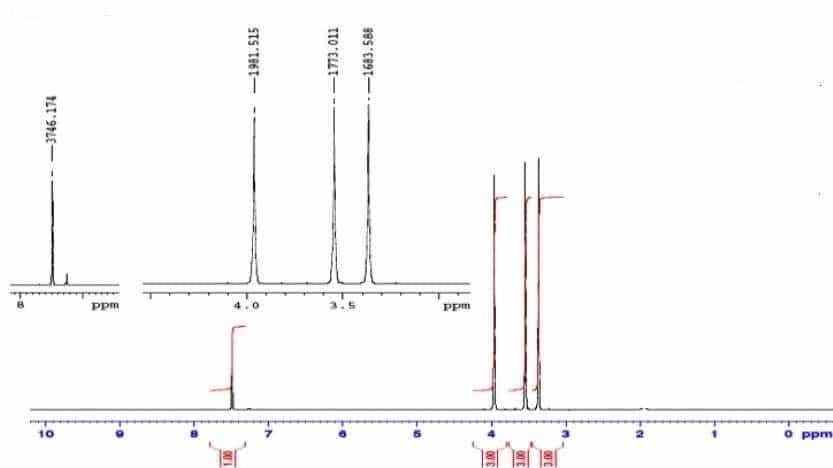
1.5. Commenter les courbes d’intégration des signaux.
2. Nombre maximal de gélules de guarana ingérable par jour
Le spectre d’absorption de la caféine, pour une solution aqueuse de caféine, est donné ci-dessous :
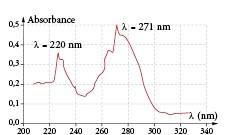
2.1. À quelle longueur d’onde doit-on régler le spectrophotomètre pour effectuer l’analyse quantitative de la caféine dans la gélule ? Peut-on utiliser un spectrophotomètre visible pour réaliser cette analyse ?
2.2. La molécule de caféine est-elle colorée ? Justifier.
2.3. Combien de gélules un adolescent de 60 kg peut-il ingérer sans aucun risque pour sa santé ?























Si vous désirez une aide personnalisée, contactez dès maintenant l’un de nos professeurs !
Très bien mais se serait vmrt bien qu’il y est des corrigés
[color=orange]super pour les exercices !, merci bien !!
mais…
Comment savoir si se que l’on a fait est juste ou non ??
n’y a t-il pas de corrigés??
Dommage…[/color]
Comment extraire les espèces chimiques responsables du goût de vanille?