Chapitres
La mole est une unité fondamentale de mesure en chimie, utilisée pour quantifier la quantité de substances. Une mole contient environ 6,022 x 10^23 entités, que ce soit des atomes, des molécules ou d'autres particules.
🧪 Les formules chimiques sont des expressions qui représentent la composition des substances. La formule empirique donne les rapports d'atomes dans un composé, tandis que la formule moléculaire indique le nombre exact d'atomes présents.
Ces concepts sont essentiels pour comprendre les réactions chimiques et les relations entre les quantités de substances impliquées, ce qui est crucial pour la compréhension de divers phénomènes chimiques et physiques.

Définitions essentielles pour comprendre la mole 🙄

Quantité de matière
Une quantité de matière, notée n, représente un nombre de « paquets » d'entités chimiques identiques. Elle est noté n et s'exprime en mol.
La constante d'Avogadro
La constante d'Avogadro, notée NA, est le nombre qui permet de relier une quantité de matière n d'un échantillon au nombre N d'entités identiques. Elle est exprimée sans unité et notée Na (Na = 6,022.1023).
Mole
Une mole est un paquet de 6,022.1023 entités chimiques identiques.
Masse molaire
La masse molaire, notée M, attribuée a un élément chimique est la masse d'une mole d'atomes de cet élément chimique.Elle s'exprime en gramme par mole(g.mol-1).
Masse molaire d'une espèce chimique, noté M : masse d'une mole de cette espèce chimique. Elle se calcule à partir des masses molaires attribuées à chaque élément chimique présente dans sa formule.
Volume molaire
Le volume molaire, noté Vm, d'une espèce chimique est le volume occupé par une mole de cette espèce chimique.
Concentration molaire
La concentration molaire d'une espèce chimique en solution, notée c, est la quantité de matière de soluté présente par litre de solution.
Calculer l'avancement d'une réaction grâce à la concentration molaire volumique 🔢

Si on ne prend en compte que le cas particulier d'une réaction ayant lieu en solution aqueuse telle que le volume V de la solution soit constant, alors on peut utiliser l'expression suivante :
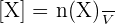
Avec :
- [X] représentant la concentration molaire (en mol.L-1) ;
- n(X) représentant la quantité de matière de l'espèce X en solution (en mol) ;
- V représentant le volume de la solution (en L).
D'après ce qui précède, en divisant tous les termes de la relation de définition de l'avancement par V :

Rappels
🧑🔬 Considérons la réaction chimique dont l'équation est : aA + bB ![]() cC + dD où A et B sont les réactifs, C et D les produits et a, b, c et d sont les nombres stœchiométriques.
cC + dD où A et B sont les réactifs, C et D les produits et a, b, c et d sont les nombres stœchiométriques.
Les notations utilisées dans la suite sont résumées ci-dessous :
- x : avancement de la réaction ;
- n(A)0 : quantité de matière initiale de A ;
- n(A) : quantité de matière de A à la date t ;
- n(A)f : quantité de matière finale de A.
L'avancement final est un avancement qui est réellement observé, atteint. Mais l'avancement maximal correspond également à l'avancement atteint lorsqu'un réactif est entièrement consommé (avancement théorique observable).
- En reprenant l'exemple précédent, x est appelé avancement de la réaction à la date t. Ce nombre permet de suivre l'évolution de la transformation et donc de caractériser le système à un moment donné.
- L'avancement maximal xmax s'obtient en écrivant que les quantités de matières des réactifs sont toujours positives ou nulles.
Nous supposerons, cette année qu'une réaction s'arrête lorsqu'un des réactifs a été totalement consommé. Ce réactif est appelé réactif limitant. Il est tel que sa quantité de matière est nulle (il n'en reste plus) lorsque x = xmax, c'est-à-dire lorsque l'avancement est maximal.
Dans certains cas tous les réactifs sont totalement consommés. On dit alors qu'ils ont été introduits dans les proportions stœchiométriques.
Taux d'avancement τ
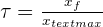
- Si τ ≤ 1 => si τ = 1 xf = xmax alors on est en présence d'une réaction totale
- τ < 1 , xf ≠ xmax alors on est en présence d'une réaction partielle qui s'arrête lorsqu'elle atteint l'équilibre chimique.
Lien entre quantité de matière et mole
✍🏼 La mole est une unité de quantité de matière. La quantité de matière se note n et s'exprime en mole de symbole mol. Le nombre d'entités élémentaire contenue dans une mole est appelé Constante d'Avogadro, noté Na.
Il faut savoir que la valeur du nombre d'Avogadro a évolué au court du temps :
- Avant le 20 mai 2019, le nombre d'Avogadro, et donc la mole, était défini comme correspondant au nombre d'atome de carbone dans 12 grammes (donc 10-3 kg) de carbone 12. On avait alors : NA = 6,022 140 857 . 1023 mol−1.
- Or, depuis le 20 mai 2019, le kilogramme a été redéfini. Ainsi, on fit le choix de définir le nombre d'Avogadro comme étant une constante fixée par convention. Aujourd'hui, la valeur du nombre d'Avogadro est donc : NA = 6,022 140 76 . 1023 mol−1
Il y a proportionnalité entre le nombre N d'entités élémentaires dans un échantillon et sa quantité de matière n :
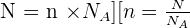
Lien entre la mole et la masse molaire 🔗
La masse d'une mole d'atomes est appelée masse molaire atomique, noté M et d'unité g / mol. En chimie, on ne compte pas en nombre d'ions ou d'atomes mais en nombre de paquets, un paquet s'appelle une mole (mol). Une mole contient 6,02 . 1023 entités.
⚛️ Le nombre de masse d’un atome correspond au nombre de nucléons qu’il contient. Il s’agit donc de la somme du nombre de protons et du nombre de protons qui constituent le noyau de l’atome.
- La masse molaire correspond aussi au nombre de nucléons dans le noyau. A = 59, signifie qu'il y a 56 nucléons dans le noyau (et 59 grammes dans une mole).
- Dans le tableau périodique, la masse molaire est souvent différente de A à cause des isotopes.
- Des isotopes sont des atomes qui possèdent le même nombre de protons mais un nombre différent de neutrons.
Retrouver la masse molaire grâce à d'autres grandeurs physiques

Le volume d'une espèce chimique
On utilise le mètre cube de symbole m3. On utilise plutôt le litre en chimie (L).
👉 1 m3 = 1000 L et 1 mL = 1 cm3
La masse volumique d'un échantillon est le rapport de la masse m de cet échantillon à son volume v. (ρ est la masse volumique) :
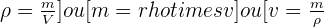
💧 La densité d'un liquide est égale au quotient de la masse d'un volume v par la masse d'un même volume d'eau (la densité s'exprime sans unité) :
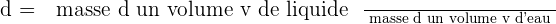
Selon le domaine dans lequel ce mot est utilisé, la définition peut être différente. Mais, dans tous les cas, le volume représente une grandeur qui permet la mesure de l'extension d'un objet ou d'une partie de l'espace.
- En sciences physiques, le volume d'un objet permet de mesurer l'extension dans l'espace physique que celui-ci possède et ce dans les trois directions de façon simultanée et de façon similaire à l'aire d'une figure dans le plan qui, quant à elle, mesure l'extension que celle-ci possède dans deux directions de façon simultanée.
- En mathématiques, le volume d'une partie de l'espace géométrique correspond à sa mesure dans le sens de la théorie de la mesure de Lebesgue.
Il peut être intéressant de connaître la notion de volume afin de déduire la masse d'un objet défini grâce notamment à la bien connue masse volumique !
La concentration molaire et la dilution
🔬 La dilution correspond à un procédé qui consiste en l'obtention d'une solution finale qui présentera une concentration inférieure à la concentration de la solution de départ. Il est alors possible de procéder à cela grâce à un ajout de solvant ou encore en prélevant une partie de la solution puis de compléter jusqu'à atteindre le volume souhaité avec du solvant.
Il est alors possible de caractériser une dilution par son taux de dilution. Mais pour cela, il est nécessaire de présupposer que le corps dilué est soluble dans le solvant qui est utilisé.
Dilution par ajout de solvant
On note la concentration d'une solution C et il est possible de la calculer avec la formule suivante :

Avec :
- C la concentration molaire. Cette unité s'exprime en mol.L-1 ;
- n la quantité de matière du soluté en solution. Cette unité s'exprime en mol ;
- Et V le volume de solvant. Cette unité s'exprime en L.
Ainsi, si on procède à une dilution par ajout de solvant, la solution initiale et la solution finale contiennent autant de quantité de soluté. Cela signifie alors que ninitiale = nfinale .
On a alors les relations suivantes qui se dégagent :
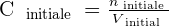
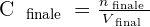
On peut déduire de ces relations le rapport suivant :
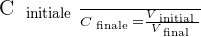
Le taux de dilution
Il est possible d'exprimer le taux de dilution avec la relation suivante :
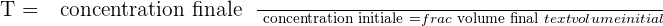
🚨 Il est important de savoir que le taux de dilution, noté T, est une grandeur sans unité et qui présente obligatoirement une valeur positive et inférieure à 1.
Quant au taux de dilutions successives, il correspond au produit des taux de dilution de chaque dilution.
Exemple
Si on procède à une dilution à 3 % puis à 5 %, on a T qui est égal à :

La masse d'une espèce chimique

💪 En physique, la masse correspond à une grandeur physique positive et intrinsèque d'un corps.
De façon plus précise, en physique newtonienne, la masse correspond à une grandeur extensive. Cela signifie alors que la masse d'un corps formé de parties correspond à la somme des masses de ces différentes parties qui le compose.
De plus, il est essentiel de noter que la masse est une grandeur conservative. De ce fait, elle reste constante dans le cas d'un système isolé qui n'échange donc pas de matière avec son environnement.
Pour une espèce donnée, la masse m, la quantité de matière n et la masse molaire M sont liés par :
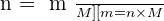
Les propriétés
La masse peut se manifester au travers de deux propriétés fondamentales :
- En effet, en mécanique statique, la masse est correspond à l'un des premières grandeurs facilement mesurables par les gens via le système de pesée puisque celle-ci permet de comparer la masse de l'objet défini avec un masse étalon connue. On appellera alors ce système la masse pesante. C'est ainsi que l'on liera la quantité de matière d'un corps à sa masse
- Tandis qu'en mécanique dynamique, la masse correspond à une grandeur qui intervient dans le principe fondamental de la dynamique comme étant la résistance de la matière au changement de vitesse. En effet, plus la masse d'un corps est importante, plus il faudra exercer une force importante pour modifier la direction ou encore sa vitesse. On appelle alors ce phénomène "masse inerte"
Ainsi, cet aspect de la masse présente un rôle essentiel dans tous les domaines de la dynamique puisqu'elle correspond à une notion présente dans grand nombre de relations de physique classique ou encore dans les calculs qui permettent de les définir.
🏋🏻♀️ En effet, il est possible de constater une proportionnalité entre la masse inerte et la masse pesante et cela de façon totalement indépendante de la nature du matériau mis en jeu. Cela permet alors de prendre la même unité pour la masse pesante et la masse inerte et donc de pouvoir les définir comme étant égale. Ainsi, cette équivalence a permis de définir un principe d'équivalence.
L'unité
L'unité de masse est le kilogramme dans le Système international d'unités (S.I.). Comme pour le litre il existe des sous-unités :
- kg
- hg
- dag
- g
- dg
- cg
- mg
🙅♂️ Attention à ne pas faire comme une majorité et confondre la masse avec le poids. En effet, dans le vocabulaire de la physique, le poids correspond à la force exercée par la gravité sur un corps pesant.
La masse se mesure avec une balance
Balance de Roberval
C'est généralement avec cet outil qu'on vous a sensibilisé en école primaire à la notion de masse bien que, très souvent, les professeurs sèment la confusion en utilisant le terme de "poids" alors méfiez-vous de ce que vous pensez savoir !
⚖️ La balance de Roberval à deux fléaux correspond à un instrument de pesage nommé ainsi en hommage à son inventeur qui n'est d'autre que Gilles Personne de Roberval, un célèbre mathématicien mais aussi physicien français né en 1602.
Petite anecdote amusante, ce scientifique est connu sous le nom de Roberval puisque celui-ci était originaire de Roberval dans l'Oise.
Le mathématicien Gille Personne a inventé cette balance lorsqu'il a eu l'idée de place des plateaux au-dessus du fléau alors que, de façon traditionnelle, ces plateaux étaient suspendus en dessous du fléau. Ainsi, Le principe de l'énigme statique expliquant que les positions des masses sur les plateaux ne perturbent pas le résultat final de la mesure, sera présenté sous la forme de thèse devant l'Académie royale des sciences par Gilles Personne de Roberval en 1669.
Balance électronique
Cette balance correspond à ce que vous trouverez certainement dans vos cuisines. Un plateau unique avec un écran indiquant la mesure avec une précision dépendant de l'appareil. Il est à noter que la balance la plus sensible au monde a vu le jour en 2012 par des chercheurs de l’Institut Catalan de Nanotechnologie. Celle-ci permet de peser au yoctogramme près.























Si vous désirez une aide personnalisée, contactez dès maintenant l’un de nos professeurs !
C’est très intéressant. Est-ce-vous pouvez m’aime à travailler cette exercice : on porte à 80°c dans un réservoir 5 litres 0,8mole de CO et 0,8 mole Br2
CO(g)+Br2(g)est en équilibre COBr2(g) KC=4,95l/mol
A/Quelle est la concentration molaire de chaque entité chimique quand l’équilibre est atteint ?
B/si on ajoute 0,5mole de Br2 au mélange à l’équilibre, que devient la concentration molaire de chaque entité chimique quand l’équilibre sera rétabli?
Bonjour, nous serions ravis de vous aider ! Rendez-vous sur la plateforme de Superprof, sélectionnez la rubrique « Découvrir nos Superprofs » en indiquant la matière souhaitée. Vous trouverez de nombreux professeurs près de chez vous. Bonne journée ! 🙂
je me demandais c’est quoi Cm ?
Bonjour, nous serions ravis de vous aider ! Avez-vous essayé de contacter l’un de nos professeurs pour recevoir une aide personnalisée ? Rendez-vous sur la plateforme de Superprof, sélectionnez la rubrique “Découvrir nos Superprofs” en indiquant la matière désirée. Vous trouverez de nombreux professeurs près de chez vous. Excellente journée ! 🙂
J’aime bien c’est intéressant mais le niveau. Est. Haut
bonjour comment trouver n avec le volume merci
Ouii
Est ce qu’il ya une relation n=vm×M