Chapitres

Introduction
La mole est une unité faisant partie intégrante du Système International. Elle a commencé à être utilisée en 1971.
Le système international d'unités, abrégé en SI, est le système décimal des unités de mesures le plus utilisé au monde. L’ensemble des unités associées aux dimensions fondamentales constitue le système international d’unités. Il s’agit du système MksA (mètre, kilogramme, seconde, Ampère), mais le Kelvin, la mole et le candela font aussi partie de ce système. Ces unités sont appelées unités légales. Elles sont universelles et connues de par le monde entier.

La quantité de matière est noté : n.
Mole = mol = unité de quantité de matière (n).
La Mole est la réunion d'un nombre bien déterminé (6,02.1023) d’entités élémentaires. On appelle ce nombre le nombre d'Avogadro.
Constante d'Avogadro = 6,02.1023 (correspond au nombre d'atomes de carbone 12 contenu dans 12,0 g de carbone 12). On la note Na = nombre d'entités élémentaires contenues dans 1 mole.
Na=6,02.1023 mol-1
La quantité de matière (n) d'un échantillon est égale au rapport de nombre N de ces entités élémentaires par le nombre d'Avogadro Na
n = N/Na avec :
- n en mol ;
- N sans unité ;
- Na en mol-1.
Masse molaire
M= masse d'atome de cet élément, elle est noté Mx et exprimé en g.mol-1. On les trouve dans le tableau des classification périodiques des éléments.
Masse molaire moléculaire - Masse d'une molle de molécule
Ex : H2O = m(H2O)=2m(H)+m(O) masse Na Na*m(H2O)=2Na*m(H)+Na*m(O) M(H2O)=2*M(H)+M(O) Elle s'obtient en faisant les sommes des masses molaires atomiques et des atomes qui constitue la molécules.
La masse d'une mole d'atomes est appelée masse molaire atomique, noté M et d'unité g / mol. En chimie, on ne compte pas en nombre d'ions ou d'atomes mais en nombre de paquets, un paquet s'appelle une mole (mol). Une mole contient 6,02 x 1023 entités. Le nombre de masse d’un atome correspond au nombre de nucléons qu’il contient. Il s’agit donc de la somme du nombre de protons et du nombre de protons qui constituent le noyau de l’atome. La masse molaire correspond aussi au nombre de nucléons dans le noyau. A = 59, signifie qu'il y a 56 nucléons dans le noyau (et 59 grammes dans une mole). Dans le tableau périodique, la masse molaire est souvent différente de A à cause des isotopes. Des isotopes sont des atomes qui possèdent le même nombre de protons mais un nombre différent de neutrons.
Masse et quantité de matière
La quantité de matière n(x) a un échantillon d'une espèce chimique x de masse m(x) est donné par la relation: n(x)=m(x)/M(x) avec :
- n(x)= quantité de matière en mol ;
- m(x)= masse en g ;
- M(x)= masse molaire en g.mol-1 .
d'où :
m(x)=n(x)*m(x) et M(x)=m(x)/n(x)
Volume molaire d'un gaz
Volume occupé par une mol de ce gaz dans des condition de température et de pression données, Vm qui s'exprime en L.mol-1.
Loi d'Avogadro-Ampère
Dans les mêmes T° et pression, tout les gaz ont le même volume molaire.
Volume molaire et quantité de matière
Le Volume V(x) d'un échantillon d’espèce chimique x et sa quantité de matière n(x) sont reliés par la relation :
n(x)=V(x)/V(m)
avec :
- n(x) en mol ;
- V(x) en L ;
- Vm en L.mol-1.
Masse volumique
µ=m/V
On utilise le mètre cube de symbole m3.
On utilise plutôt le litre en chimie ( L ). 1 m3 = 1000 L et 1 mL = 1 cm3
La masse volumique d'un échantillon est le rapport de la masse m de cet échantillon à son volume v.
p est la masse volumique.
p = m / v ou m = p x v ou v = m / p
La densité d'un liquide est égale au quotient de la masse d'un volume v par la masse d'un même volume d'eau.
La densité s'exprime sans unité et d = masse d'un volume v de liquide/ masse d'un volume v d'eau.

Résumé
- Quantité de matière, noté n : une quantité de matière représente un nombre de « paquets » d'entités chimiques identiques. Elle est noté n et s'exprime en mol.
- La constante d'Avogadro, noté NA : la constante d'Avogadro est le nombre qui permet de relier une quantité de matière n d'un échantillon au nombre N d'entités identiques. Elle est exprimée sans unité et notée Na (Na = 6,022.1023)
- Mole : une mole est un paquet de 6,022.1023 entités chimiques identiques.
- Masse molaire, noté M : la masse molaire attribuée a un élément chimique est la masse d'une mole d'atomes de cet élément chimique.Elle s'exprime en gramme par mole(g.mol-1).
- Masse molaire d'une espèce chimique, noté M : masse d'une mole de cette espèce chimique. Elle se calcule à partir des masses molaires attribuées à chaque élément chimique présente dans sa formule ;
- Volume molaire, noté Vm : le volume molaire Vm d'une espèce chimique est le volume occupé par une mole de cette espèce chimique ;
- Concentration molaire, noté c : la concentration molaire d'une espèce chimique en solution est la quantité de matière de soluté présente par litre de solution.
Exercice
Le rhum est une boisson alcoolisée, fabriquée à partir de la canne à sucre. Chaque rhum a ses particularités gustatives dues à divers facteurs : variétés de cannes, lieux de cultures…
Seules certaines boissons alcoolisées, directement issues de la canne ont droit à l'appellation "rhum".

L'industrie alimentaire met sur le marché de nombreux produits à odeur de rhum mais, pour des raisons économiques, beaucoup ne contiennent pas de "rhum". Ces produits tiennent leur odeur d'une molécule (notée Y) que l'on peut obtenir par synthèse.
Formule semi-développée de l'ester Y :
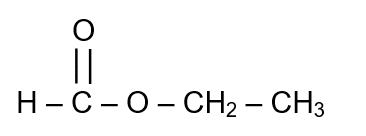
Données :
| Espèce | Masse molaire M ( g.mol–1 ) | Température d'ébullition θ ( °C ) |
|---|---|---|
| A | 46 | 101 |
| B | 46 | 78 |
| Y | 74 | 55 |
| W | 18 | 100 |
1. Transformation (N° 1) d'un mélange d'acide carboxylique (A) et d'alcool primaire (B)
1.1. Donner, en formules semi-développées, l'équation de la réaction de synthèse de Y.
De façon simplifiée, elle sera notée : A + B = Y + W.
1.2. Nommer Y.
Dans un ballon de 250 mL contenant 1,20 mol de B, 4 gouttes de solution d'acide sulfurique concentré ( H2SO4 ) et quelques grains de pierre ponce, on ajoute 1,20 mol de A (système S1 ).
On chauffe à reflux jusqu'à l'obtention de tout l'ester possible.
1.3. Le document 1 (voir annexe) représente les quantités de matière des réactifs et des produits dans l'état initial et dans l'état final.
L'état final est-il un équilibre chimique? Justifier.
1.4. Calculer la constante de réaction K associée à cet équilibre.
1.5. Compléter le tableau d'avancement en faisant apparaître x et xf (document 2, en annexe, à rendre avec la copie).
1.6. Exprimer le quotient de réaction Qr dans l'état intermédiaire où l'avancement est x.
1.7. Calculer l'avancement final xf . Montrer que ce résultat est compatible avec les valeurs du tableau.
1.8. Calculer le rendement h1 de la transformation 1 (exprimé en pourcentage).
2.Transformation (N°2)
On considère un nouveau système S2, que l'on chauffe à reflux.
S2 ne diffère de S1 que par une donnée : on introduit 2,4 mol de A à la place de 1,2 mol.
Quand l'équilibre est atteint, un dosage montre qu'il reste 1,4 mol de A.
2.1. Calculer le nouveau rendement h2 .
2.2. Comparer h1 et h2, et justifier.
3. Transformation (N°3)
Le ballon contenant S1 est maintenant équipé d'une colonne à distiller et d'un réfrigérant, permettant la récupération d'un distillat. En tête de colonne, un thermomètre permet de suivre la température.
Celle-ci monte jusqu'à 55°C environ et se stabilise pendant un certain temps.
Lorsque la température monte à nouveau, on arrête le chauffage. On pèse alors le distillat recueilli : m = 85,8 g.
3.1. Donner, en justifiant, la nature du distillat obtenu.
3.2. Calculer le rendement h3.
3.3. Comparer h1 et h3, et justifier.

| Équation de la réaction | A + B = Y + W | ||||
|---|---|---|---|---|---|
| Etat du système | Avancement x (mol) | nA (mol) | nB (mol) | nY (mol) | nW (mol) |
| initial | 0 | 1,20 | 1,20 | ||
| intermédiaire | x | ||||
| final | xf | ||||
Calculer l'avancement d'une réaction grâce à la concentration molaire volumique
Si on ne prend en compte que le cas particulier d'une réaction ayant lieu en solution aqueuse telle que le volume V de la solution soit constant, alors on peut utiliser l'expression suivante : [ [X] = \frac {n(X)} {V} ] Avec :
- [X] représentant la concentration molaire (en mol.L-1) ;
- n(X) représentant la quantité de matière de l'espèce X en solution (en mol) ;
- V représentant le volume de la solution (en L).
D'après ce qui précède, en divisant tous les termes de la relation de définition de l'avancement par V : [frac {x} {V} = \frac { [A] _ {0} - [A] } {a} = \frac { [ B ] _ { 0 } - [B] } {b} = \frac {[C]} {c} =frac {[D]} {d} ]






















Si vous désirez une aide personnalisée, contactez dès maintenant l’un de nos professeurs !
Bonjour, le cours est nickel ! par contre n’y a t-il pas de correction pour l’exercice ?
Bonjour, merci à vous pour votre fidélité ! Voici des exercices avec correction sur le sujet : https://www.superprof.fr/ressources/scolaire/physique-chimie/exercice-ps-3/2nde-ps-3/quantite-matiere-exercice.html
Bonne journée !