Chapitres

Le caoutchouc naturel
Le mot caoutchouc provient de l'indien : cao (bois) et ochu (pleurer). Quand on pratique une incision (saignée) dans l'écorce de l'hévéa, un liquide laiteux (latex) s'écoule goutte à goutte, composé de 1/3 de caoutchouc et de 2/3 d'eau. Le latex est d'abord filtré puis traité par une solution acide diluée. On constate alors qu'il y a coagulation, le caoutchouc apparaît, sous forme solide, en suspension. Après laminage, les feuilles de caoutchouc sont séchées et pressées en balles, constituant la matière première utilisée dans l'industrie.

Le caoutchouc synthétique
En 1929, on réussit à fabriquer un polymère du butadiène et du styrène en présence de sodium comme catalyseur. Le polymère appelé S.B.R. (styrène -butadiène rubber) fut développé industriellement par l'Allemagne après 1930. En 1942, les Etats Unis, privés par les Japonais de leurs approvisionnements en caoutchouc naturel, développèrent la production de S.B.R. En améliorant les propriétés mécaniques de ce produit. Cet élastomère synthétique, supérieur au caoutchouc naturel, équipe actuellement l'ensemble de nos automobiles.
Les origines du caoutchouc
Plusieurs arbres proposent naturellement une production de caoutchouc :
- La guayule ;
- Le caoutchouc ;
- Le Castilla elastica ;
- Le pissenlit de Russie ;
- Le Funtumia elastica ;
- L'hévéa ;
- Le caoutchouc d'herbe.
On trouve en général ces arbres du côté des Amériques, notamment vers le Mexique.
Le latex, provenance du du caoutchouc se constitue à 70 % d'eau et de 30 % de matière sèche.
Pour la production synthétique de caoutchouc, cette dernière s'effectue de manière chimique.
La production du caoutchouc
Une fois extrait, le caoutchouc et séché pour en éliminer l'eau. Il est ensuite pressé. Maintenant, il faut lui apporter d'autres molécules telles que du zinc, du soufre, du carbone ou encore de la silice. Pour finir, les des polymères synthétiques sont ajoutés afin de lui conférer des propriétés élastiques.
Ensuite vient alors la partie de la vulcanisation. Cette dernière consiste à donner au caoutchouc sa structure indéformable et son élasticité. La vulcanisation est une opération chimique qui va lier les chaînes de polymères des ponts sulfure. De l'oxyde de zinc est intégré en guise de catalyseur.

Les changements d'état
L'état solide est l'état le plus "serré" de la matière. En effet, toutes les molécules sont collées les unes au autres, c'est ce qui donne à l'élément sa solidité. L'état liquide est un intermédiaire entre l'état solide et l'état gazeux. La matière y est malléable et coule. L'état gazeux est l'état dans lequel la matière est la plus dissipée. En effet, un gaz occupe toute la place qu'on lui offre, ce qui signifie qu'il peut s'étendre. Le plasma apparaît dans des conditions de température et de pression extrêmes. Dans ces conditions, même la structure atomique est totalement désorganisée. Ainsi, dans l’état de plasma, les constituants de l'atome se séparent. Les noyaux et les électrons se déplacent indépendamment et forment un mélange globalement neutre. Cet état de neutralité en fait l’état le plus important de l’Univers : le plasma représente près de 90% de la matière visible.
Il existe en tout 6 changements d'états possibles. Ce sont les six transformations fondamentales qui interviennent en chimie. Nous prendrons pour les détailler l'exemple de l'eau.
La fusion
La fusion intervient lorsque de la glace fond. Par exemple, un glaçon dans un verre d'eau. Il s'agit donc du passage de l'état solide à l'état liquide.
La vaporisation
La vaporisation est le passage de l'état liquide à l'état gazeux. Même si le nom est proche, cela n'a aucun rapport avec le fait de projeter de l'eau avec un vaporisateur. La vaporisation a lieu lorsqu'on laisse évaporer de l'eau au soleil ou quand on la porte à ébullition.
La liquéfaction
Il s'agit de la transformation inverse de la vaporisation. Elle intervient quand de la vapeur d'eau se transforme en eau liquide. La liquéfaction a lieu soit par compression : la pression qui augmente rends l'eau gazeuse liquide ou par refroidissement et dans ce cas le gaz refroidit pour devenir liquide, c'est la condensation.
La solidification
La solidification est le phénomène durant lequel l'eau liquide devient solide. Cela se produit quand elle gèle, on parle alors de congélation. L'eau se met à se solidifier une fois qu'elle descend en dessous de 0° C. L'eau peut aussi se solidifier en cas de cristallisation ou d'augmentation de la pression.

La sublimation
La sublimation intervient quand l'eau passe directement de l'état solide à l'état gazeux. Cela fait que la glace devient vapeur sans même passer par les étapes habituelles de fusion et de vaporisation. Cela peut arriver lorsque de l'eau très chaude entre en contact avec de l'air très froid. Elle part alors en fumée blanche (de la vapeur d'eau).
La condensation solide
La condensation solide est le phénomène qui se produit lorsque de l'eau sous forme de vapeur vient toucher une surface très froide. Par exemple, si l'on souffle sur une vitre gelée, la vapeur d'eau contenue dans notre respiration gèlera instantanément en se transformant en eau solide.
Mais pour comprendre ces changements d'état, il faut d'abord connaître les états de la matière. Nous prendrons ici l'exemple de l'eau.
Les états de la matière
L'eau peut se trouver sous ses 3 états à la surface de la Terre. En effet, elle est liquide dans nos rivières et lorsqu'on la boit, gazeuse dans l'air que nous respirons et dans la vapeur d'eau et pour finir solide sur les glaciers ou dans les glaçons.
Les précipitations et leurs états
Toutes les précipitations que nous subissons à la surface de la Terre ne présentent pas d'états identiques. En effet, dans certains cas il s'agit de précipitations solides et dans d'autres il s'agit de précipitations liquides.
La pluie
C'est un phénomène qui se forme à partir des gouttelettes contenues dans les nuages ou des cristaux de glaces qui ne sont pas assez froids pour rester congelés lors de leur chute. Il existe plusieurs formes de pluies : la bruine qui est caractérisée quand les gouttes d'eau mesurent moins de 1,5 mm ; la pluie verglaçante qui se forme quand les conditions de pression et température du sol sont inférieures au point de congélation alors que ce n'était pas le cas dans l'atmosphère.
La grêle
Elle est représentée par des billes de glace mesurant de 5 à 50 mm même si parfois ces billes, appelées grêlons, peuvent atteindre la taille d'une balle de tennis. Leur vitesse de chute monte jusqu'à 160 km/h, ce qui cause de nombreux dégâts.
La neige
Les conditions pour l’apparition de neige sont très particulières. De la vapeur se transforme en cristaux de glace et ces derniers doivent s'assembler rapidement pour former des flocons. Ce procédé à lieu à des températures qui permettent d'éviter la fonte du flocon durant sa chute. En moyenne, il neige entre -3°C et 3°C.
Le grésil
Il est composé de grêlons qui sont devenus liquides durant leur chute mais se remettent à geler une fois entrés dans la masse d'air froide inférieure à 0°C. Son cœur reste donc liquide et son enveloppe solide.
L'eau solide
L'eau atteint son état solide lorsque la température atteint ou descend les 0° C. Les molécules adoptent donc une structure cristalline.
L'eau liquide
On peut trouver de l'eau liquide dans les conditions climatiques habituelles de nos environnements de vie. En effet, sous pression atmosphérique normale de 1 bar et entre 0° C et 100° C, l'eau prend sa forme liquide. Elle adopte alors une structure plus désordonnée et prends moins de place. C'est pourquoi l'eau gelée occupe plus de place que l'eau liquide.
L'eau gazeuse
La majorité de l'eau gazeuse est celle que nous respirons dans l'air. A pression normale de 1 bar et une fois passé la barre des 100° C, l'eau devient gazeuse et l'on parle alors de vapeur d'eau. C'est aussi l'état de l'eau qui s'évapore (au-dessus des lacs, rivières ou océans). Les molécules d'eau sont dans leur état le plus agité lorsqu'elles sont gazeuses. L'attraction terrestre s'exerce alors moins dessus et permet au gaz de expanser.
La production du caoutchouc est possible grâce à des réactions chimiques
Une réaction chimique entre deux réactifs se produit toujours dans des proportions et des quantités bien déterminées. Il est donc important de savoir quelles sont ces proportions. Par exemple, dans l'industrie, il est important de connaître ces proportions car sinon elle gâchera une partie des réactifs nécessaires à la réaction. C'est dans cette optique que l'on se doit d'équilibrer l'équation bilan d'une réaction chimique. Pour ce faire, il faut procéder avec méthode et suivre les étapes suivantes.
Nous prendront par la suite, l'exemple de la combustion du méthane dans le dioxygène.
Le déroulement d'une réaction
- 1ère étape : on réalise d'abord l'expérience puis on identifie les produits formés (dans notre cas,le dioxyde de carbone et de l'eau) ; on note les réactifs (ce que l'on a avant la réaction) et les produits formés (après la réaction). Pour notre exemple cela donne :
- Réactifs: méthane, dioxygène
- Produits: dioxyde de carbone, eau
- Réactifs: méthane, dioxygène
- 2ème étape : on écrit alors en toutes lettres le bilan de la réaction :
- Avant la flèche c'est à dire avant la réaction on écrit les réactifs.
- Après la flèche c'est à dire après la réaction on écrit les produits
- 3ème étape : on remplace alors les noms des réactifs et des produits par leur formule chimique correspondante:
- 4ème étape : il faut donc trouver les nombres de molécules qui permettront d'avoir le même nombre de chaque type d'atomes avant et après la réaction : on va équilibrer en atomes l'équation bilan de la réaction chimique. Pour cela, repartons donc de l'équation bilan de départ. On constate que le nombre de chaque type d'atomes n'est pas le même avant et après la réaction: on dit que l'équation bilan n'est pas équilibrée en atomes.
Cela signifie, dans la réalité, que ce n'est pas une molécule de méthane qui réagit avec une molécule de dioxygène pour former une molécule de dioxyde de carbone et une molécule d'eau mais d'autres quantités de molécules qui réagissent pour former d'autres quantités de molécules.
Avancement d'une réaction chimique
Considérons la réaction chimique dont l'équation est : aA + bB ![]() cC + dD où A et B sont les réactifs, C et D les produits et a, b, c et d sont les nombres stœchiométriques. Les notations utilisées dans la suite sont résumées ci-dessous :
cC + dD où A et B sont les réactifs, C et D les produits et a, b, c et d sont les nombres stœchiométriques. Les notations utilisées dans la suite sont résumées ci-dessous :
- x : avancement de la réaction ;
- n(A)0 : quantité de matière initiale de A ;
- n(A) : quantité de matière de A à la date t ;
- n(A)f : quantité de matière finale de A.
L'avancement final est un avancement qui est réellement observé, atteint. Mais l'avancement maximal correspond également à l'avancement atteint lorsqu'un réactif est entièrement consommé (avancement théorique observable). En reprenant l'exemple précédent, x est appelé avancement de la réaction à la date t. Ce nombre permet de suivre l'évolution de la transformation et donc de caractériser le système à un moment donné. L'avancement maximal xmax s'obtient en écrivant que les quantités de matières des réactifs sont toujours positives ou nulles. Nous supposerons, cette année qu'une réaction s'arrête lorsqu'un des réactifs a été totalement consommé. Ce réactif est appelé réactif limitant. Il est tel que sa quantité de matière est nulle (il n'en reste plus) lorsque x = xmax, c'est-à-dire lorsque l'avancement est maximal. Dans certains cas tous les réactifs sont totalement consommés. On dit alors qu'ils ont été introduits dans les proportions stœchiométriques.
Taux d'avancement τ
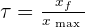
- Si τ ≤ 1 => si τ = 1 xf = xmax alors on est en présence d'une réaction totale
- τ < 1 , xf ≠ xmax alors on est en présence d'une réaction partielle qui s'arrête lorsqu'elle atteint l'équilibre chimique.
Utilisations du caoutchouc
De nos jours, nous consommons plus de 22 mégatonnes de caoutchouc. Sur ces 22 mégatonnes, 9 mégatonnes sont du caoutchouc d'origine naturelle.
Environ 70 % de la production part directement dans la fabrication de pneus.
Ensuite viennent les productions pour l'industrie : des gaînes, des courroies, etc.
Le gazon synthétique pour les sports de raquettes par exemple utilise du caoutchouc dans sa fabrication.
Ensuite, en médecine, le latex est très souvent utilisé pour les gants jetables. Cependant, il peut causer des allergies aux protéines de l'hévéa.

Écotoxicité et recyclage
Le caoutchouc n'est pas un matériau recyclable, contrairement aux matières plastiques habituelles. Pour cause, il n'a toujours été trouvé aucun moyen pour lui permettre de garder ses caractéristiques.
Cependant, on peut le réutiliser pour d'autres produits comme des bitumes par exemple.
De par ses caractéristiques et sa biodégradabilité limitée, le caoutchouc jeté dans la nature peut être considéré comme un matériau écotoxique.
On dit d’un objet qu’il est écotoxique lorsqu’il est toxique pour l’environnement, c’est-à-dire polluant
Questions d'entraînement
1/ Sous quel état se trouve le caoutchouc dans le latex qui s'écoule des saignées de l'hévéa ?
2/ Que faut il faire pour que le latex coagule ? Qu'obtient on après coagulation ?
3/ Qu'est ce que le laminage ? Qu'obtient on après le laminage ?
4/ Pourquoi les industriels fabriquent ils du caoutchouc de synthèse ? Donner plusieurs raisons.
5/ Rechercher une ou plusieurs propriétés mécaniques concernant le caoutchouc.
6/ Le tableau suivant donne, en millions de tonnes, la production annuelle mondiale de caoutchouc naturel (C.N.) et de caoutchouc synthétique (C.S.) :
| Année | 1938 | 1955 | 1960 | 1970 | 1975 | 1980 | 1991 |
|---|---|---|---|---|---|---|---|
| Caoutchouc naturel | 0,89 | 1,95 | 2,03 | 3,1 | 3,1 | 3,8 | 5,4 |
| Caoutchouc synthétique | 0,02 | 1,5 | 2,5 | 5,9 | 6,9 | 8,7 | 8,9 |
Sur un graphique porter en abscisse l'année et en ordonnée la production, en millions de tonnes, d'une part du C.N. Et d'autre part du C.S. Commenter.
7/ Citer quelques exemples























Si vous désirez une aide personnalisée, contactez dès maintenant l’un de nos professeurs !