Chapitres

Solution aqueuse

On appelle solution électrolytique toute solution obtenue par la dissolution d'une substance appelée soluté dans un liquide que l'on appelle solvant. Le soluté peut être sous la forme de solide, de gaz ou de liquide et si l'eau constitue le solvant de la solution, on parle alors de solution aqueuse. De ce fait, une solution électrolytique correspond à une solution contenant des ions. Elle est alors conductrice tout en étant électriquement neutre.
Remarque
La connaissance de la verrerie, de la précision que l'on peut en attendre et des usages que l'on peut en faire sont indispensables.
Définitions
Une solution est un liquide contenant plusieurs constituants
- Le constituant majoritaire est appelé solvant. Si le solvant est l'eau, la solution est appelée solution aqueuse.
- Le (ou les) composé(s) mis en solution est (sont) appelé(s) soluté(s).
- Les espèces en solution sont soit des molécules soit des ions.
Concentration d'une espèce en solution

Définition
La concentration molaire d'une espèce chimique en solution est la quantité de matière de cette espèce présente dans un litre de solution.
Relation de définition et unités de mesure
Soit [X] la concentration de l'espèce X en solution (on la note aussi C(X)), n(X) la quantité de matière de X en solution et V le volume de la solution. On a : 
Avec :
- n(X) en mol
- V en L
- [X] en mol.L-1
Rappels sur le volume, la mole et la masse molaire
Le volume
On utilise le mètre cube de symbole m3. On utilise plutôt le litre en chimie (L). 1 m3 = 1000 L et 1 mL = 1 cm3 La masse volumique d'un échantillon est le rapport de la masse m de cet échantillon à son volume v. (ρ est la masse volumique) 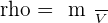 ou
ou  ou
ou 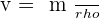 La densité d'un liquide est égale au quotient de la masse d'un volume v par la masse d'un même volume d'eau. (la densité s'exprime sans unité)
La densité d'un liquide est égale au quotient de la masse d'un volume v par la masse d'un même volume d'eau. (la densité s'exprime sans unité) 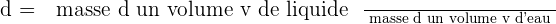
Définition
Selon le domaine dans lequel ce mot est utilisé, la définition peut être différente. Mais, dans tous les cas, le volume représente une grandeur qui permet la mesure de l'extension d'un objet ou d'une partie de l'espace.
- En sciences physique, le volume d'un objet permet de mesurer l'extension dans l'espace physique que celui-ci possède et ce dans les trois directions de façon simultanée et de façon similaire à l'aire d'une figure dans le plan qui, quant à elle, mesure l'extension que celle-ci possède dans deux directions de façon simultanée.
- En mathématiques, le volume d'une partie de l'espace géométrique correspond à sa mesure dans le sens de la théorie de la mesure de Lebesgue.
Il peut être intéressant de connaître la notion de volume afin de déduire la masse d'un objet défini grâce notamment à la bien connue masse volumique !
La mole
La mole est une unité de quantité de matière. La quantité de matière se note n et s'exprime en mole de symbole mol. Le nombre d'entités élémentaire contenue dans une mole est appelé Constante d'Avogadro, noté Na. Il faut savoir que la valeur du nombre d'Avogadro a évolué au court du temps :
- Avant le 20 Mai 2019, le nombre d'Avogadro, et donc la mole, était défini comme correspondant au nombre d'atome de carbone dans 12 grammes (donc 10-3 kg) de carbone 12. On avait alors : NA = 6,022 140 857 . 1023 mol−1.
- Or, depuis le 20 Mai 2019, le kilogramme a été redéfini. Ainsi, on fit le choix de définir le nombre d'Avogadro comme étant une constante fixée par convention. Aujourd'hui, la valeur du nombre d'Avogadro est donc : NA = 6,022 140 76 . 1023 mol−1
Il y a proportionnalité entre le nombre N d'entités élémentaires dans un échantillon et sa quantité de matière n : 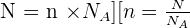
La masse molaire
La masse d'une mole d'atomes est appelée masse molaire atomique, noté M et d'unité g / mol. En chimie, on ne compte pas en nombre d'ions ou d'atomes mais en nombre de paquets, un paquet s'appelle une mole (mol). Une mole contient 6,02 . 1023 entités. Le nombre de masse d’un atome correspond au nombre de nucléons qu’il contient. Il s’agit donc de la somme du nombre de protons et du nombre de protons qui constituent le noyau de l’atome. La masse molaire correspond aussi au nombre de nucléons dans le noyau. A = 59, signifie qu'il y a 56 nucléons dans le noyau (et 59 grammes dans une mole). Dans le tableau périodique, la masse molaire est souvent différente de A à cause des isotopes. Des isotopes sont des atomes qui possèdent le même nombre de protons mais un nombre différent de neutrons.
Préparation d'une solution aqueuse
Par mise en solution d'un solide

Détermination de la masse de soluté à peser
Soit à préparer un volume V d'une solution contenant l'espèce X, de masse molaire M(X), à la concentration [X]. Il faut, en général, déterminer la masse de l'espèce X à peser. Soit m(X) cette masse.  or
or 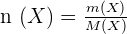 Donc
Donc  et
et 
Rappels sur la masse
En physique, la masse correspond à une grandeur physique positive et intrinsèque d'un corps. De façon plus précise, en physique newtonienne, la masse correspond à une grandeur extensive. Cela signifie alors que la masse d'un corps formé de parties correspond à la somme des masses de ces différentes parties qui le compose. De plus, il est essentiel de noter que la masse est une grandeur conservative. De ce fait, elle reste constante dans le cas d'un système isolé qui n'échange donc pas de matière avec son environnement. Pour une espèce donnée, la masse m, la quantité de matière n et la masse molaire M sont liés par : 

Les propriétés
La masse peut se manifester au travers de deux propriétés fondamentales : En effet, en mécanique statique, la masse est correspond à l'un des premières grandeurs facilement mesurables par les gens via le système de pesée puisque celle-ci permet de comparer la masse de l'objet défini avec un masse étalon connue. On appellera alors ce système la masse pesante. C'est ainsi que l'on liera la quantité de matière d'un corps à sa masse. Tandis qu'en mécanique dynamique, la masse correspond à une grandeur qui intervient dans le principe fondamental de la dynamique comme étant la résistance de la matière au changement de vitesse. En effet, plus la masse d'un corps est importante, plus il faudra exercer une force importante pour modifier la direction ou encore sa vitesse. On appelle alors ce phénomène "masse inerte". Ainsi, cet aspect de la masse présente un rôle essentiel dans tous les domaines de la dynamique puisqu'elle correspond à une notion présente dans grand nombre de relations de physique classique ou encore dans les calculs qui permettent de les définir. En effet, il est possible de constater une proportionnalité entre la masse inerte et la masse pesante et cela de façon totalement indépendante de la nature du matériau mis en jeu. Cela permet alors de prendre la même unité pour la masse pesante et la masse inerte et donc de pouvoir les définir comme étant égale. Ainsi, cette équivalence a permis de définir un principe d'équivalence.
L'unité
L'unité de masse est le kilogramme dans le Système international d'unités (S.I.). Comme pour le litre il existe des sous-unités : kg ; hg ; dag ; g ; dg ; cg ; mg. Attention à ne pas faire comme une majorité et confondre la masse avec le poids. En effet, dans le vocabulaire de la physique, le poids correspond à la force exercée par la gravité sur un corps pesant.
Opérations à effectuer

Par dissolution d'un gaz

Soit V(G) le volume de gaz à dissoudre, V le volume de la solution, Vm le volume molaire des gaz dans les conditions de l'expérience, n(G) la quantité de matière de gaz et [G] la concentration molaire du gaz dans la solution. On a :  or
or  Donc
Donc 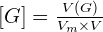
Gaz : pression et quantité de mouvement
La pression
La pression correspond à une grandeur physique qui permet de traduire les échanges de quantité de mouvement au sein d'un système thermodynamique, notamment au sein d'un solide ou encore d'un fluide. On peut alors définir la pression comme correspondant à l'intensité de force que va exercer un fluide par unité de surface. La pression est une grandeur scalaire, voire tensorielle, intensive. Il faut être prudent lorsque l'on parle de la pression. En effet, nombreux sont ceux qui parlent de pression exercée par un fluide sur une paroi pour parler de la force pressante que le fluide va exercer par unité d'aire de la paroi. Cependant, la force correspond plutôt à une grandeur vectorielle que l'on définit localement alors que la pression correspond à une grandeur scalaire qui est définie en tout point du fluide concerné.
Les unités de pression
L'unité de pression est le Pascal noté (Pa), même si l'on parle parfois du Bar qui, lui, n'est pas une unité du Système International. L'analyse dimensionnelle de la pression permet de montrer que celle-ci est homogène à une force surfacique (1 Pa = 1 N/m²) comme à une énergie volumique (1 Pa = 1 J/m3).
Quelques formules
La pression p, le volume V, la quantité de matière n, et la température T d'un gaz sont liés par : [ P \times V = n \times R \times T ] Avec R = 8,31 USI Le volume molaire d'un gaz Vm est le volume occupé par 1 mole de ce gaz dans des conditions de température et de pression donnés. On peut déterminer ainsi le volume molaire par la formule suivante :  En sachant que Vm s'exprime en L.mol-1 Pour ce qui est des gaz, le volume V et la quantité de matière n sont liés par :
En sachant que Vm s'exprime en L.mol-1 Pour ce qui est des gaz, le volume V et la quantité de matière n sont liés par : 
La quantité de mouvement
En physique, on appelle la quantité de mouvement tout produit de la masse par le vecteur vitesse d'un corps matériel que l'on suppose ponctuel. Ainsi, la quantité de mouvement correspond à une grandeur vectorielle que l'on définit par 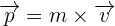 qui dépendra du référentiel d'étude. De plus, en utilisant l'additivité, on est capable de définir la quantité de mouvement d'un corps non ponctuel ou système matériel. De ce fait, il devient possible de démontrer que la quantité de matière est égale à la quantité de mouvement du centre d'inertie de l'objet étudié affecté de la masse totale du système. On a donc
qui dépendra du référentiel d'étude. De plus, en utilisant l'additivité, on est capable de définir la quantité de mouvement d'un corps non ponctuel ou système matériel. De ce fait, il devient possible de démontrer que la quantité de matière est égale à la quantité de mouvement du centre d'inertie de l'objet étudié affecté de la masse totale du système. On a donc 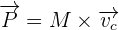 où C correspond au centre d'inertie. On utilise le kg.m.s-1 comme unité. De façon logique et naturelle, la notion de quantité de mouvement s'introduit en dynamique. En effet, la relation fondamentale de la dynamique exprime le fait que l'action d'une force extérieure sur un système conduit à une variation de sa quantité de mouvement par l'expression suivante :
où C correspond au centre d'inertie. On utilise le kg.m.s-1 comme unité. De façon logique et naturelle, la notion de quantité de mouvement s'introduit en dynamique. En effet, la relation fondamentale de la dynamique exprime le fait que l'action d'une force extérieure sur un système conduit à une variation de sa quantité de mouvement par l'expression suivante : 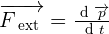 On peut également dire de la notion de quantité de mouvement qu'elle fait partie, de la même façon que l'énergie, des grandeurs qui se conservent dans un système isolé et donc un système qui n'est soumis à aucune action extérieure ou alors ces mêmes actions extérieures sont négligeables ou se compensent. On utilise d'ailleurs fréquemment cette propriété en théorie des collisions.
On peut également dire de la notion de quantité de mouvement qu'elle fait partie, de la même façon que l'énergie, des grandeurs qui se conservent dans un système isolé et donc un système qui n'est soumis à aucune action extérieure ou alors ces mêmes actions extérieures sont négligeables ou se compensent. On utilise d'ailleurs fréquemment cette propriété en théorie des collisions.  . Dans le cas d'un champ électromagnétique, on appelle la quantité de mouvement impulsion. Elle fait alors référence à la densité volumique d'impulsion du champ donné par la formule :
. Dans le cas d'un champ électromagnétique, on appelle la quantité de mouvement impulsion. Elle fait alors référence à la densité volumique d'impulsion du champ donné par la formule : 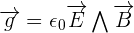
Par dilution d'une solution (la solution fournie est en général appelée solution mère)
La dilution correspond à un procédé qui consiste en l'obtention d'une solution finale qui présentera une concentration inférieure à la concentration de la solution de départ. Il est alors possible de procéder à cela grâce à un ajout de solvant ou encore en prélevant une partie de la solution puis de compléter jusqu'à atteindre le volume souhaité avec du solvant. Il est alors possible de caractériser une dilution par son taux de dilution. Mais pour cela, il est nécessaire de présupposer que le corps dilué est soluble dans le solvant qui est utilisé.
Dilution par ajout de solvant
On note la concentration d'une solution C et il est possible de la calculer avec la formule suivante :  Avec :
Avec :
- C la concentration molaire. Cette unité s'exprime en mol.L-1 ;
- n la quantité de matière du soluté en solution. Cette unité s'exprime en mol ;
- Et V le volume de solvant. Cette unité s'exprime en L.
Ainsi, si on procède à une dilution par ajout de solvant, la solution initiale et la solution finale contiennent autant de quantité de soluté. Cela signifie alors que ninitiale = nfinale . On a alors les relations suivantes qui se dégagent : 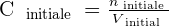
 On peut déduire de ces relations le rapport suivant :
On peut déduire de ces relations le rapport suivant : 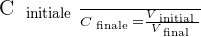
Le taux de dilution
Il est possible d'exprimer le taux de dilution avec la relation suivante : 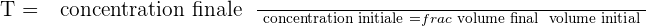 Il est important de savoir que le taux de dilution, noté T, est une grandeur sans unité et qui présente obligatoirement une valeur positive et inférieure à 1. Quant au taux de dilutions successives, il correspond au produit des taux de dilution de chaque dilution.
Il est important de savoir que le taux de dilution, noté T, est une grandeur sans unité et qui présente obligatoirement une valeur positive et inférieure à 1. Quant au taux de dilutions successives, il correspond au produit des taux de dilution de chaque dilution.
Exemple
Si on procède à une dilution à 3 % puis à 5 %, on a T qui est égal à : 
Opérations à effectuer

Méthode pour résoudre un exercice
Mise en situation
Si vous disposez de 100 ml d'une solution de concentration 15 g/L. Comment devez-vous procéder si vous souhaitez transformer la solution de telle sorte qu'elle soit concentrée à 5 g/L. Pour diminuer la concentration d'une solution, il faut y ajouter du solvant. Il est alors nécessaire de tout d'abord commencer l'exercice en identifiant les données clairement. Cette étape doit toujours être présente lorsqu'il s'agit d'un problème où l'on diminue la concentration d'une solution.
Identification des données
- C1 = 15 g/L, cela correspond à la concentration initiale ;
- V1 = 100 mL, cette valeur correspond au volume initial ;
- C2 = 5 g/L, cette valeur correspond alors à la concentration finale ;
- V2 = ? ce qui correspond au volume final de la solution.
Première façon de résoudre le problème
Tout d'abord, il est nécessaire de se demander de combien la concentration finale est plus petite que la concentration initiale. On procède au calcul suivant : 15 ÷ 5 = 3 permettant de déterminer que la concentration finale est 3 fois plus petite que la concentration initale. Ainsi, on déduit que le volume final doit être 3 fois plus grand que le volume initial. Donc, 3 x 100 ml = 300 ml. Le volume final doit donc être de 300 ml. Puisqu'on commence avec 100 ml, il ne reste qu'à ajouter 200 ml de solvant (300 ml - 100 ml) pour diminuer la concentration de notre solution.
Deuxième façon de résoudre le problème
- On utilise la relation suivante :
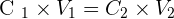
- On isole la variable inconnue, ici, le volume final afin d'obtenir :
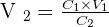
- On remplace les chiffres dans l'équation en s'assurant que les unités de la concentration initiale et de la concentration finales soient identiques.
- On obtient alors : V2 = 300 ml (Les unités sont en ml puisque les g/L s'annulent entre eux.)
- Le volume final étant de 300 ml, on doit ajouter 200 ml de solvant à notre solution qui en contenait déjà 100 ml au départ.























Si vous désirez une aide personnalisée, contactez dès maintenant l’un de nos professeurs !
Merci beaucoup
C’est très aidant
merci pour ces cours en ligne continuez comme ça vous m’aidez bien