Chapitres

Définitions
Une transformation chimique est la transformation d'espèces chimiques appelées réactifs en d'autres espèces chimiques appelées produits. Cette transformation s'opère par un réarrangement des éléments chimiques.
Ecriture d'une transformation
Les entités entrantes en réaction ( réactifs ) vont se casser par rupture de certaines liaisons et libérer des éléments chimiques ou groupes d'élément chimiques. Ces éléments ou groupes vont se combiner entre eux en formant de nouvelles liaisons donc de nouvelles espèces chimiques appelées produits. On peut dés lors écrire un schéma globale d'une transformation chimique : Attention ! Un changement d'état n'est pas une transformation chimique mais une transformation physique.
Energie libérée
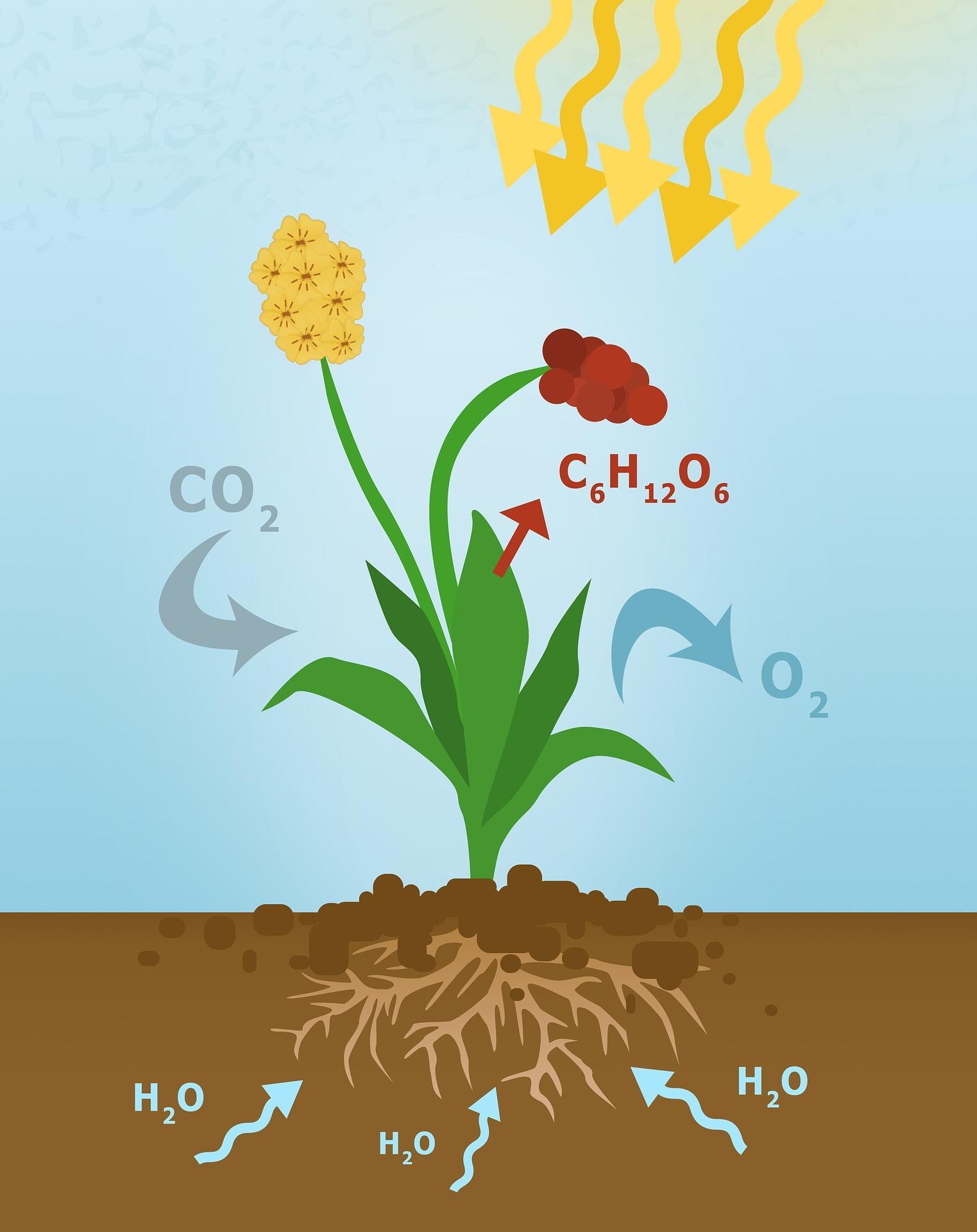
La chlorophylle a pour propriété d’absorber les radiations lumineuses (et donc l'énergie solaire) afin de les restituer sous forme d’énergie chimique qui sera ensuite réutilisée par la plante (là on parle de la chaîne de transport d'électron du thyllakoïde qui permet la formation de proton ou d'ADP qui est la monnaie énergétique).
Et on a la phase nocturne (qu'on appelle aussi phase sombre) cette phase permet la fixation du carbone du CO2 (c'est le cycle de Krebs avec intervention de la RuBisCo), en libérant l’oxygène, pour synthétiser du sucre (grosso merdo du saccharose). et donc l'énergie qui a été accumulée par la plante lors du jour est utilisée pour effectuer des synthèses chimiques suivant un cycle qui a été découvert par Melvin Calvin (d'où le nom de cycle de Calvin).
La fonction d'enthalpie
Pour tout système thermodynamique, il est défini une fonction d'état appelée enthalpie libre ou encore énergie de Gibbs. Cette fonction, notée G, est telle que G = H - TS avec :
- H l'enthalpie en joules ;
- T la température en kelvin ;
- et S l'entropie en J.K-1.
Cette fonction d'enthalpie libre est une fonction d'état considérée comme indispensable pour l'étude des équilibres chimiques. En effet, cette fonction ne peut que décroître dans le cas d'une transformation à pression et température constantes selon le deuxième principe de la thermodynamique. Cela permet donc, dans le cas d'une réaction chimique effectuée à T et P constantes, d'avoir le signe de l'enthalpie libre de réaction qui indique le sens dans lequel se déplace l'équilibre chimique. Ainsi, lorsque l'enthalpie libre atteint un minimum et donc qu'elle ne varie plus, alors l'équilibre chimique est atteint.
La chaleur d'une réaction chimique
Chaleur de réaction
Au cours d'une réaction chimique, on dit que le système échange de l'énergie avec le milieu extérieur. Cet échange se fait sous la forme de transfert thermique, anciennement appelé chaleur. Cette énergie échangée sous forme de transfert thermique Q dépend des conditions expérimentales dans lesquelles se produit la réaction :
- Volume constant, on parle d'une transformation isochore, la thermodynamique montre que Q est égale à la variation d'énergie interne du système. On peut alors noter Qv = ΔU (c'est notamment le cas de la bombe calorimétrique) ;
- Pression constante, la chaleur est égale à la variation d’enthalpie : Qp = ΔH (ce qui représente le cas très fréquent des réactions effectuées à l’air libre).

La vitesse de réaction d'une transformation chimique
Définition
La vitesse est une grandeur physique qui est définie par une évolution face au temps. La vitesse ne définit pas qu'uniquement la vitesse de déplacement mais peut aussi correspondre à la vitesse de réaction chimique ou encore une vitesse de séchage par exemple. En règle générale, une vitesse est égale à la division de la mesure d'une variation telle qu'une longueur, un volume ou encore un poids par la mesure du temps écoulé au cours de cette variation. L'exemple le plus simple est celui de la vitesse de déplacement. Il s'agit d'une distance divisée par un temps comme les mètres par seconde ou les kilomètres par heure. En connaissant l'énergie du système qui va réagir, on peut savoir si la réaction va se produire ou non ainsi que l'énergie qui sera nécessaire pour franchir le seuil de l'énergie d'activation. Une vitesse de réaction dépendra donc de certains caractères tels que :
- La pression : plus elle sera élevée, plus la réaction sera rapide ;
- La température : plus la température est élevée, plus les molécules sont excitées. Elles seront donc plus rapides à réagir ;
- Les radiations environnantes : des radiations comme les radiations électromagnétiques favorisent la cassure des liaisons entre les molécules ;
- La concentration des molécules : plus il y a de molécules et plus il y a de collisions potentielles entre celles-ci ;
- La surface de la réaction : plus celle-ci sera grande, plus les molécules pourront réagir rapidement ;
- L'énergie d'activation : si elle est suffisante, alors la réaction aura lieu. Autrement, elle ne se fera pas.
Calculer une vitesse de réaction
En règle générale, une vitesse se calcule avec la formule suivante : [ text { vitesse moyenne du parcours } = \frac {text {distance parcourue}} {text {temps de parcours } } ] Dans le cas d'une réaction chimique, on appliquera la formule suivante : [ v = \frac {ab} {cd} \frac { text {d} x } { text {d} t} ] avec :
- v : vitesse volumique de réaction (en mol.m-3.s-1) ;
- V : volume de la solution (en m3) ;
- dx : variation de l'avancement (en mol) ;
- dt : durée de la variation (en s).
Remarques
- Il arrive fréquemment que le volume V soit exprimé en litre. La vitesse de réaction est alors exprimée en mol.L-1.s-1 ;
- Si la transformation est lente ou très lente la durée peut être exprimée en minute ou en heure. La vitesse de réaction est alors exprimée en mol.L-1.min-1 ou en mol.L-1.h-1 ;
- Le rapport dx/dt représente la dérivée par rapport au temps de l'avancement.
Ce qu'il faut connaître pour déterminer v
D'après la relation de définition , il faut connaître V et la fonction x=f(t). Cette fonction peut être connue soit:
- Par son graphe (il est donné dans certains exercices) ;
- Par un tableau de mesures présentant les valeurs des couples {ti ; xi} (il est donné dans certains exercices) ;
- A l'aide du tableau d'avancement de la réaction. Il faut alors connaître,soit par une méthode chimique soit par une méthode physique, l'évolution de la concentration de l'un des réactifs ou de l'un des produits de la transformation. Etudier les deux TP de cinétique chimique.
Méthodes
- Graphiquement: On trace la tangente à la courbe x=f(t) à la date t choisie. La valeur du rapport dx/dt est égal au coefficient directeur de cette tangente ;
- On divise alors cette valeur par la valeur de V (volume de la solution) ;
- Par le calcul: Un tableur calcule directement la vitesse v à partir des valeurs de V, ti et xi.
Evolution de la vitesse de réaction au cours du temps
Au cours du temps les réactifs disparaissent donc leur concentration diminue. Or nous avons déjà vu que la concentration des réactifs est un facteur cinétique. Plus la concentration des réactifs est faible plus la réaction est lente. Donc, en général, au cours du temps la vitesse de réaction diminue.
Différents types de réactions
Il existe deux types de réactions : les réactions totales et les réactions partielles. 
Définitions
Considérons la réaction chimique dont l'équation est: aA + bB ![]() cC + dD où A et B sont les réactifs, C et D les produits et a, b, c et d sont les nombres stœchiométriques. Les notations utilisées dans la suite sont résumées ci-dessous:
cC + dD où A et B sont les réactifs, C et D les produits et a, b, c et d sont les nombres stœchiométriques. Les notations utilisées dans la suite sont résumées ci-dessous:
- x : avancement de la réaction ;
- n(A)0 : quantité de matière initiale de A ;
- n(A) : quantité de matière de A à la date t ;
- n(A)f : quantité de matière finale de A.
Il en est de même pour les autres espèces. L'avancement final est un avancement qui est réellement observé, atteint. Mais l'avancement maximal correspond également à l'avancement atteint lorsqu'un réactif est entièrement consommé.
Exemple du chlorure d'hydrogène et de l'eau
On prépare V = 100 mL d'une solution d'acide chlorhydrique de concentration c = 1,0.10-2 mol/L par dissolution du chlorure d'hydrogène HCl dans l'eau, on mesure le pH de la solution qui est de 2,0.
[ CV - x _ { text { max } } = 0 ]
[ x _ { text { max } } = CV = 1,0 . 10 ^ { - 2 } times 0,1 = 1,0 . 10 ^ { - 3 } text { mol } ]
[ pH = 2,0 ]
[ left[ H _ { 3 } 0 ^ { + } right] = 1,0 . 10 ^ { - 2 } text { mol/L }
[ eta left[ H _ { 3 } 0 ^ { + } right] = left[ H _ { 3 } 0 ^ { + } right] V = 1,0 . 10 ^ { - 2 } times 10 ^ { - 3 } text { mol } ]
[ eta left[ H _ { 3 } 0 ^ { + } right] = x _ { f } = 1,0 . 10 ^ { - 3 } text { mol } ]
[ x _ { f } = x _ { text { max } } ]
L'avancement observé xf est égal à l'avancement maximal observable.
Quelques notions importantes

Couche de valence
On appelle couche de valence d’un atome la dernière couche électronique remplie. Ce sont les électrons qui composent cette dernière couche de valence qui interviennent dans les réactions chimiques.
Allotropie
L'allotropie est la faculté de certains corps simples d'exister sous plusieurs formes cristallines ou moléculaires différentes. Une forme allotropique peuvent avoir des propriétés physique, comme la couleur et la dureté, et une réactivité chimique différentes même si elles sont composées d'atomes identique. Les transformations d'une forme allotropique à l'autre peuvent être induites par des changements de pression et de température ou même par une réaction chimique. Certaines formes ne sont stables que sous certaines conditions définies de température et de pression.
Électropositivité
On définit l'électronégativité d'un élément chimique à sa capacité à attirer les électrons lorsqu'il réagit avec d'autres éléments au sein d'une réaction chimique.
Réaction d’oxydoréduction
Une réaction d'oxydoréduction, également appelée réaction redox, correspond à une réaction chimique au cours de laquelle à lieu un transfert d'électron. C'est-à-dire une réaction durant laquelle une espèce chimique dite oxydant reçoit un ou plusieurs électrons d'une autre espèce chimique dite réducteur.























Si vous désirez une aide personnalisée, contactez dès maintenant l’un de nos professeurs !
Je voudrais savoir si quels que soient les réactifs chois la réaction aura lieu ou pas ?
Bonjour ! Le réactif est primordial, et il semble logique que non !
Bonne journée!
les documents mis a disposition sont [bgcolor=red]illisibles !!!!!!![/bgcolor]
et les textes(exemple:définition )ne sont pas très compris par moi !!