Chapitres

Les différents états de l'eau
L'eau peut se trouver sous ses 3 états à la surface de la Terre. En effet, elle est liquide dans nos rivières et lorsqu'on la boit, gazeuse dans l'air que nous respirons et dans la vapeur d'eau et pour finir solide sur les glaciers ou dans les glaçons.
L'eau solide
L'eau atteint son état solide lorsque la température atteint ou descend les 0° C. Les molécules adoptent donc une structure cristalline.
L'eau liquide

On peut trouver de l'eau liquides dans les conditions climatiques habituelles de nos environnements de vie. En effet, sous pression atmosphérique normale de 1 bar et entre 0° C et 100° C, l'eau prend sa forme liquide. Elle adopte alors uns structure plus désordonnée et prends moins de place. C'est pourquoi l'eau gelée occupe plus de place que l'eau liquide.
L'eau gazeuse
La majorité de l'eau gazeuse est celle que nous respirons dans l'air. A pression normale de 1 bar et une fois passé la barre des 100° C, l'eau devient gazeuse et l'on parle alors de vapeur d'eau. C'est aussi l'état de l'eau qui s'évapore (au dessus des lacs, rivières ou océans). Les molécules d'eau sont dans leur état le plus agité lorsqu'elles sont gazeuses. L'attraction terrestre s'exerce alors moins dessus et permet au gaz de s'expanser.
Il existe en tout 6 changements d'états possibles pour l'eau. Ce sont les six transformations fondamentales qui interviennent en chimie.
La fusion
La fusion intervient lorsque de la glace fond. Par exemple, un glaçon dans un verre d'eau. Il s'agit donc du passage de l'état solide à l'état liquide.
La vaporisation
La vaporisation est le passage de l'état liquide à l'état gazeux. Même si le nom est proche, cela n'a aucun rapport avec le fait de projeter de l'eau avec un vaporisateur. La vaporisation a lieu lorsqu'on laisse évaporer de l'eau au soleil ou quand on la porte à ébullition.
La liquéfaction
Il s'agit de la transformation inverse de la vaporisation. Elle intervient quand de la vapeur d'eau se transforme en eau liquide. La liquéfaction a lieu soit par compression : la pression qui augmente rends l'eau gazeuse liquide ou par refroidissement et dans ce cas le gaz refroidit pour devenir liquide, c'est la condensation.
La solidification
La solidification est le phénomène durant lequel l'eau liquide devient solide. Cela se produit quand elle gèle, on parle alors de congélation. L'eau se met à se solidifier une fois qu'elle descend en dessous de 0° C. L'eau peut aussi se solidifier en cas de cristallisation ou d'augmentation de la pression.
La sublimation
La sublimation intervient quand l'eau passe directement de l'état solide à l'état gazeux. Cela fait que la glace devient vapeur sans même passer par les étapes habituelles de fusion et de vaporisation. Cela peut arriver lorsque de l'eau très chaude entre en contact avec de l'air très froid. Elle part alors en fumée blanche (de la vapeur d'eau).
La condensation solide
La condensation solide est le phénomène qui se produit lorsque de l'eau sous forme de vapeur vient toucher une surface très froide. Par exemple, si l'on souffle sur une vitre gelée, la vapeur d'eau contenue dans notre respiration gèlera instantanément en se transformant en eau solide.
Exercices pour s'entraîner
Exercice 1

Le montage représenté ci-dessous permet de distiller de l'eau salée. 1. Quel est le rôle du soleil?
2. A quoi servent le film plastique et le caillou ?
3. Que récupère-t-on dans le verre ?
4. L'eau du récipient est-elle plus ou moins salée à la fin de l'expérience ? Justifiez.
5. Comment s'appelle la transformation physique que subit l'eau dans cette expérience ?
6. Au niveau de la lumière le film plastique transparent est-il une source primaire, un objet diffusant ou aucun des deux ? Même question pour le soleil.
7. Comment a-t-on pu obtenir de l'eau salée pour l'expérience ? Donnez le terme physique précis.
Exercice 2
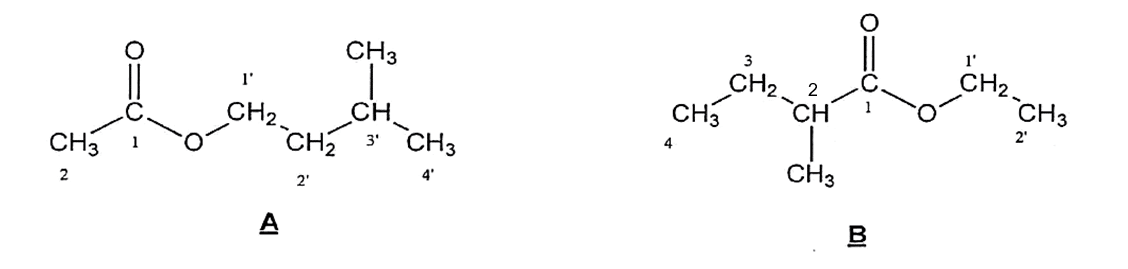
Lorsque des pommes mûrissent, leurs membranes cellulaires s'oxydent, engendrant la dégradation des acides gras à longues chaînes qu'elles contiennent. Il en résulte la formation de deux molécules A et B représentées ci-dessous. Ces deux espèces chimiques, dont les concentrations augmentent lors du mûrissement des pommes, ont la propriété de masquer la saveur caractéristique du fruit non mûr.
Les molécules A et B présentent les formules semi-développées suivantes :
Données :
Températures d'ébullition sous une pression de 1 bar
| Composé | Molécule A | Stéréoisomère B1 de B | Stéréoisomère B2 de B |
|---|---|---|---|
| Température d'ébullition sous une pression de 1 bar (en °C) | 142 | 133 | 133 |

Solubilités dans différents solvants
| Eau à 20 °C | Eau salée saturée à 20 °C | Eau à 0 °C | |
|---|---|---|---|
| Molécule A | 2,0 g.L-1 | 0,5 g.L-1 | 1,0 g.L-1 |
| 3-méthylbutan-1-ol | faible | très faible | très faible |
| Acide éthanoïque | très forte | très forte | très forte |
Densités par rapport à l'eau à 20 °C et masses molaires en g.mol-1
| Molécule A | 3-méthylbutan-1-ol | Acide éthanoïque | Eau salée saturée | |
|---|---|---|---|---|
| Densité | 0,87 | 0,81 | 1,05 | 1,20 |
| Masse molaire (g.mol-1) | 130 | 88 | 60 |
Masse volumique de l'eau : reau = 1,00 g.mL-1
pKa à 20 °C des couples : CO2(g), H2O(l) / HCO3-(aq): 6,4 ; CH3COOH(aq) /CH3COO-(aq) : 4,8
L'acide sulfurique est un diacide fort.
Partie A : Identification des molécules A et B
1. Propriétés des molécules A et B.
Donner le nom de la fonction chimique présente dans les deux molécules A et B.
Parmi les molécules A et B, l’une se nomme éthanoate de 3-méthylbutyle.
Laquelle ? Justifier.
Préciser la formule brute des composés A et B. En déduire par quelle relation les
molécules A et B sont liées.
La molécule A présente-t-elle un (ou des) carbones asymétriques ? Si oui, le (ou les)
matérialiser sur votre copie à l'aide d'un astérisque (*).
Le composé B présente deux stéréoisomères B1 et B2 dessinés ci-dessous.

Donner le nom du type de stéréoisomérie de configuration qui lie les composés B1 et B2. Justifier.
2. Séparation des molécules A, B1 et B2 par distillation fractionnée.
On souhaite séparer par distillation fractionnée un mélange de composés B1, B2 et A.
Annoter le schéma de distillation fractionnée en ANNEXE 1 À RENDRE AVEC LA COPIE.
À l'aide des données, dire si une séparation est possible. En cas d'affirmation,
préciser, en justifiant, quel est l'ordre dans lequel on recueille les composés dans le
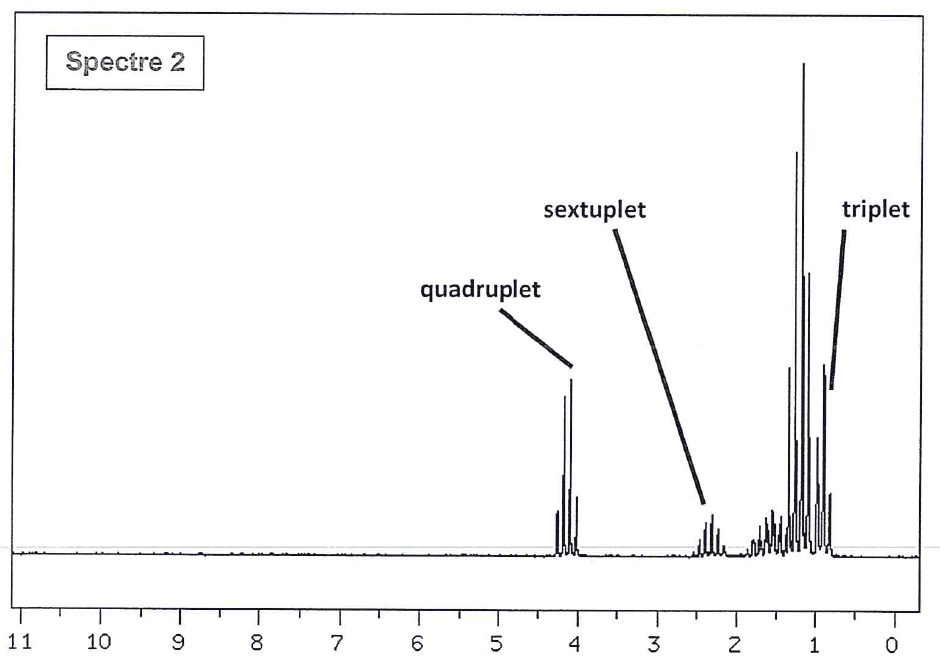
3. Identification des molécules A et B à l'aide de la spectroscopie RMN du proton 1H.
On donne en ANNEXE 2 À RENDRE AVEC LA COPIE deux spectres RMN du proton 1H correspondant aux molécules A et B.
3.1. Noter dans les tableaux donnés en ANNEXE 3 À RENDRE AVEC LA COPIE la multiplicité des hydrogènes proches des groupements –COO- des molécules A et B.
3.2. Associer alors les spectres 1 et 2 aux molécules A et B.
Partie B : Synthèse de la molécule A
1. Analyse du protocole.
Introduction des réactifs et chauffage :
Introduire dans un ballon 20,0 mL de 3-méthylbutan-1-ol, puis 30,0 mL d'acide éthanoïque pur et environ 1 mL d'acide sulfurique concentré.
Ajouter trois grains de pierre ponce.
Adapter le réfrigérant à boules et chauffer à reflux pendant 30 minutes.

Extraction de la molécule A :
Après refroidissement, verser dans le ballon environ 50 mL d'une solution froide et saturée de chlorure de sodium et transvaser le mélange dans une ampoule à décanter.
Agiter, décanter, éliminer la phase aqueuse.
Ajouter environ 50 mL d'une solution à 5 % d'hydrogénocarbonate de sodium (Na+(aq) + HCO3-(aq)).
Agiter l'ampoule jusqu'à ce qu'il n'y ait plus d'effervescence. Décanter. Éliminer alors la phase aqueuse.
Recueillir la phase organique dans un erlenmeyer, y ajouter une spatule de sulfate de magnésium
Agiter puis filtrer sur éprouvette graduée. On obtient un volume V = 18,1 mL de la molécule A.
1.1. Donner le nom et la formule du produit manquant dans l'équation :

Pour que la réaction se déroule en un temps relativement court, la présence de l'acide sulfurique est impérative. Sachant que l'acide sulfurique n'intervient pas dans le bilan réactionnel, déduire son rôle.
En utilisant les données, expliquer pourquoi on ajoute de l'eau salée (et non de l'eau) et pourquoi l'eau salée doit être froide.
Lors de la première décantation, dans quelle phase (organique ou aqueuse) se trouvent essentiellement la molécule A, l'eau, les ions, le 3-méthylbutan-1-ol (qui n'a pas réagi) et l'acide éthanoïque (en excès) ? Quelle est la phase située au-dessus ? Justifier.
Préciser la nature de l'effervescence observée lors de l'ajout de l'hydrogénocarbonate de sodium (Na+(aq) + HCO3-(aq)). Écrire l'équation de la réaction acido-basique mise en jeu.
Calcul du rendement :
Calculer les quantités de matière de 3-méthylbutan-1-ol et d'acide éthanoïque introduites dans le ballon.
En déduire le rendement r de la synthèse, défini comme le rapport entre la quantité de matière de produit A obtenu et la quantité de matière de réactif limitant.
3. Étude du mécanisme de la réaction d'estérification.
Par souci de simplification on notera R-OH le 3-méthylbutan-1-ol :

Le mécanisme réactionnel proposé pour la réaction d'estérification conduisant au composé A est proposé ci-dessous :

3.1. Indiquer dans le tableau donné en ANNEXE 4 À RENDRE AVEC LA COPIE le type de réactions correspondant aux étapes 2 et 4 du mécanisme.
Recopier l'étape 2 et dessiner les flèches courbes schématisant les transferts électroniques.
Comment le cation H+ intervient-il dans le mécanisme ? Cette observation, confirme-t-elle la réponse de la question B.1.2. ?
ANNEXE 1
Montage de distillation fractionnée :

ANNEXE 2
























Si vous désirez une aide personnalisée, contactez dès maintenant l’un de nos professeurs !
Bravo pour ce document !
C’est très intéressant.