Chapitres

Les transformations polytropiques
En physique, les transformations polytropiques sont des modifications d'état thermodynamique dans un système thermique entre ce système et l'environnement. Dans le cas d'une transformation polytropique, l'échange thermique est partiel, donc tout juste entre le cas isotherme et le cas adiabatique.
On dit d’un processus en thermodynamique qu’il est isotherme quand il s’exécute sans changement de température
Dans le domaine de la thermodynamique, un processus adiabatique est une transformation ayant lieu sans aucun transfert thermique

Le fonctionnement des transformations polytropiques
En thermodynamique, on dit qu'une transformation polytropique appliquée à un gaz, généralement parfait, est une transformation durant laquelle la pression P et le volume V du gaz est de la forme suivante :
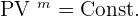
En ingénierie
En ingénierie, l'expression polytropique est utilisée pour parler des opérations avec des échanges thermiques partiels, notamment les opérations de réaction où une partie de la chaleur est échangée avec le système de contrôle de température. La conduite polytropique d'un réacteur permet alors de diminuer la puissance de refroidissement de l'installation.
Dans le cas d'une réaction exothermique, cela se traduit par une évacuation partielle de la chaleur de réaction et d'une élévation de la température au sein du réacteur. Ce genre de procédé demande une bonne connaissance de la chimie de la réaction, car une élévation de la température peut conduire à un emballement de la réaction.
Les transferts thermiques et la thermodynamique
Ce qu'on appelle transfert thermique en sciences est plus couramment appelé chaleur dans la vie quotidienne. Un transfert thermique correspond à l'un des modes d'échange d'énergie thermique entre deux systèmes. Dans le cas du double vitrage, on parlera du système extérieur et du système intérieur (la maison). Cela correspond à une notion fondamentale de la thermodynamique et, contrairement au travail, les transferts thermiques correspondent à un bilan de transferts d'énergie dits microscopiques et désordonnées.
Il est possible de distinguer trois type de transfert thermique, tous pouvant coexister :
- La conduction correspond à la diffusion progressive de l'agitation thermique dans la matière ;
- La convection correspond au transfert thermique qui accompagne des déplacements macroscopiques de la matières ;
- Et le rayonnement qui correspond à la propagation de photons.

Ainsi, la quantité de chaleur, notée Q et exprimée en joule, correspond à la quantité d'énergie qui sera échangée par le moyen de ces trois différents type de transfert. Une convention indique alors que, lorsque Q > 0, on dit que le système reçoit de l'énergie. De plus, il peut être intéressant de retenir que la thermodynamique fait appel au concept de chaleur afin de mettre en place le premier mais aussi de deuxième principe de la thermodynamique.
Malgré tout cela, il reste de nombreuses ambiguïtés mais également de nombreuses confusions qui s'entretiennent. En effet, malgré le sens que l'on accorde à chaleur dans la vie quotidienne, le principe de chaleur au sens thermodynamique du mot n'a aucun lien avec la température. Cependant, il reste vrai que les transferts thermiques spontanés se font toujours du système le plus élevé en température vers le système le moins élevé en température même s'il reste possible de provoquer l'inverse grâce à une machine thermique comme un réfrigérateur.
Il est d'ailleurs intéressant de noter que, lorsqu'il y a un changement d'état, le corps pur ne changera pas de température bien qu'il échange de l'énergie sous forme de chaleur.
Les principes de la thermodynamique
Le principe zéro de la thermodynamique
Ce principe concerne la notion d'équilibre thermique. Ainsi, il est à la base de la thermométrie et s'énonce ainsi : si deux systèmes sont en équilibre thermique avec un troisième, alors ils sont aussi ensemble en équilibre thermique.
Le premier principe de la thermodynamique
Egalement appelé principe de la conservation de l'énergie, ce principe affirme que l'énergie est toujours conservée. Formulé autrement, cela signifie que l'énergie totale d'un système isolé reste constante. Ainsi, les événements qui se produisent au sein du système isolé ne se traduisent donc que par des transformations de certaines formes d'énergie en d'autres formes d'énergie. Puisque l'énergie ne peut pas être produite en partant de rien, elle est présente en quantité invariable dans la nature. Elle ne peut donc que se transmettre d'un système à un autre : on ne crée par l'énergie, on la transforme.
Ce principe est également considéré comme étant une loi générale pour toutes les théories physiques, notamment en mécanique, électromagnétisme ou physique nucléaire puisqu'on ne lui a jamais trouvé la moindre exception même si des doutes peuvent subsister lorsque l'on étudie les désintégration radioactives.
De puis le théorème de Noether, on sait que la conservation de l'énergie est intimement reliée à une uniformité de structure de l'espace-temps.
Le premier principe de la thermodynamique rejoint alors le célèbre principe popularisé par Lavoisier : "Rien ne se perd, rien ne se crée, tout se transforme".
Le deuxième principe de la thermodynamique
Egalement appelé principe d'évolution des systèmes, ce principe affirme la dégradation de l'énergie. En effet, l'énergie d'un système passe de façon nécessaire et spontanée de formes concentrées et potentielles à des formes diffuses et cinétiques telles que le frottement ou la chaleur.
Ce principe introduit donc également la notion d'irréversibilité d'une transformation et la notion d'entropie. En effet, d'après le deuxième principe de la thermodynamique, l'entropie d'un système isolé augmente ou reste constante. Souvent interprété comme une mesure du désordre et comme l'impossibilité du passage du désordre à l'ordre sans intervention extérieur.
L'interprétation de ce principe se base sur la théorie de l'information de Claude Shannon et la mesure de cette information, également appelée entropie de Shannon.
La principale différence de ce principe avec le premier principe de la thermodynamique est l'origine statique de ce deuxième principe. En effet, les lois microscopiques qui gouvernent la matière ne le contiennent qu'implicitement et de manière statique. Cependant, le deuxième principe de la thermodynamique reste relativement indépendant des caractéristique des lois précédemment citée puisqu'il apparaît même si l'on suppose des lois simplistes à petite échelle.
Le troisième principe de la thermodynamique
Ce principe, quant à lui, est associé à la descente vers un état quantique fondamental d'un système dont la température s'approche d'une limite qui définit la notion de zéro absolu. En effet, en thermodynamique classique, ce principe permet de calculer l'entropie molaire S d'un corps pur par intégration sur la température à partir de S=0 à 0 K dans le but d'établir des tables de données thermodynamiques.
La loi de Laplace
En thermodynamique, cette loi correspond à une relation reliant la pression et le volume d'un gaz parfait qui subit une transformation dite isentropique ou une transformation dite adiabatique et réversible. Mais cette relation peut également être utilisée avec la température et le volume ainsi que la température et la pression.
La loi de Laplace suppose en effet des capacités thermiques constante alors que les capacités thermiques d'un gaz parfait dépend évidemment de la température, il suffit de regarder la loi des gaz parfait. En conséquence, cette loi ne peut être appliquée à des transformation où la variation de la température est peu important. On peut alors considérer que les capacités thermiques sont constantes.
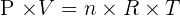
Avec :
- P est la pression d'un gaz (en pascals) ;
- V le volume occupé par le gaz (en m3) ;
- n la quantité de matière (en moles) ;
- R la constante universelle des gaz parfaits (8,3144621 J/K/mol) ;
- Et T est la température (en kelvins).

Chaleur de réaction
Au cours d'une réaction chimique, on dit que le système échange de l'énergie avec le milieu extérieur. Cet échange se fait sous la forme de transfert thermique, anciennement appelé chaleur.
Cette énergie échangée sous forme de transfert thermique Q dépend des conditions expérimentales dans lesquelles se produit la réaction :
- Volume constant, on parle d'une transformation isochore, la thermodynamique montre que Q est égale à la variation d'énergie interne du système. On peut alors noter Qv = ΔU (c'est notamment le cas de la bombe calorimétrique)
- Pression constante, la chaleur est égale à la variation d’enthalpie : Qp = ΔH (ce qui représente le cas très fréquent des réactions effectuées à l’air libre).
Enthalpie libre
Pour tout système thermodynamique, il est défini une fonction d'état appelée enthalpie libre ou encore énergie de Gibbs. Cette fonction, notée G, est telle que G = H - TS avec :
- H l'enthalpie en joules ;
- T la température en kelvin ;
- et S l'entropie en J.K-1.
Cette fonction d'enthalpie libre est une fonction d'état considérée comme indispensable pour l'étude des équilibres chimiques. En effet, cette fonction ne peut que décroître dans le cas d'une transformation à pression et température constantes selon le deuxième principe de la thermodynamique. Cela permet donc, dans le cas d'une réaction chimique effectuée à T et P constantes, d'avoir le signe de l'enthalpie libre de réaction qui indique le sens dans lequel se déplace l'équilibre chimique. Ainsi, lorsque l'enthalpie libre atteint un minimum et donc qu'elle ne varie plus, alors l'équilibre chimique est atteint.
Exercices sur les gaz parfaits
Exercice 1 : Le chlore et l'eau
1. Du chlore dans les eaux souterraines
Il existe deux principaux isotopes stables du chlore (dont les nombres de masse sont 35 et 37) trouvés dans les proportions respectives de 3 pour 1 et qui donnent aux atomes en vrac une masse molaire atomique apparente de 35,5 g.mol-1.
Le chlore a 9 isotopes avec des nombres de masse s’étendant de 32 à 40. Seulement trois de ces isotopes existent à l’état naturel : le Cl-35 stable (75,77 %), le Cl-37 stable (24,23 %) et le Cl-36 radioactif. Le rapport du nombre de noyaux de Cl-36 au nombre total de noyaux de Cl présents dans l’environnement est de 7,0×10 –13 actuellement.
Le «chlore 36» (Cl-36) se désintègre essentiellement en « argon 36 » (Ar-36). La demi-vie du Cl-36 est de 301×103 ans. Cette valeur le rend approprié pour dater géologiquement les eaux souterraines sur une durée de soixante mille à un million d’années.
Données :
Relation entre l’activité A d’un échantillon et le nombre moyen de noyaux N présent dans cet échantillon, à une date t donnée : A(t) = λ. N(t)
- 1 an = 3,156×107 s ;
- Célérité de la lumière dans le vide : c = 2,998×108 m.s-1 ;
- Masse molaire atomique du chlore : M(Cl) = 35,5 g.mol-1 ;
- Constante d’Avogadro : NA = 6,02×1023 mol-1.
Masse et numéro atomique (ou nombre de charge) de quelques particules et noyaux :
| Particule ou noyau | Proton | Neutron | Chlore 36 | Argon 36 |
|---|---|---|---|---|
| Masse (10 –27 kg) | 1,67262 | 1,67492 | 59,71128 | |
| Z | 1 | 0 | 17 | 18 |
1.1. Dans l’article, l’auteur indique des valeurs 35 et 37 pour les isotopes stables du chlore.
Que désignent plus précisément ces valeurs pour un noyau de chlore ?
1.2. Définir le terme « isotopes ».
1.3. Donner le symbole complet du noyau de « chlore 36 » et sa composition.
1.4. Calculer, en MeV, l’énergie de liaison EL1 d’un noyau de « chlore 36 ». Exprimer le résultat final avec quatre chiffres significatifs.
On rappelle que 1 eV = 1,602×10– 19 J.
1.5. Le texte évoque la réaction de désintégration d’un noyau de « chlore 36 ».
Écrire l’équation de cette réaction, en indiquant :
- les lois utilisées ;
- le type de radioactivité mise en jeu.
1.6. Donner la définition du temps de « demi-vie » t1/2 du « chlore 36 ».
1.7. Constante radioactive
1.7.1. Déterminer, par analyse dimensionnelle, l’unité de la constante radioactive λ dans le système international.
1.7.2. Calculer la constante radioactive de l’isotope de « chlore 36 » en respectant l’unité de base du système international.
1.8. Une bouteille contient un volume V= 1,5 L d’eau minérale. Sa teneur en ions chlorure est indiquée sur l’étiquette et vaut cm = 13,5 mg.L- 1.
1.8.1. Calculer la quantité d’ions chlorure, en mol, dans l’eau de cette bouteille.
1.8.2. On suppose que le rapport du nombre de noyaux de « chlore 36 » au nombre total de noyaux de chlore présents dans cette eau minérale est celui donné dans l’article.
Montrer que le nombre N de noyaux de « chlore 36 » présents dans cette bouteille est
N = 2,4×108.
1.8.3. En déduire la valeur de l’activité en « chlore 36 » de l’eau que contient cette bouteille.
1.8.4. En déduire la valeur du nombre de désintégrations de noyaux de « chlore 36 » par jour.
1.9. Datation d’une eau souterraine
L’étude des isotopes radioactifs apporte des informations concernant la durée du transit souterrain d’une eau c'est-à-dire l’âge de la nappe phréatique. Les ions chlorure Cl- (aq) sont presque toujours présents dans les eaux minérales naturelles et ne sont que rarement impliqués dans les interactions eaux - rochers. Dans les eaux de surface, le « chlore 36 » est renouvelé et la teneur en « chlore 36 » peut être supposée constante, ce qui n’est pas le cas dans les eaux souterraines des nappes phréatiques. Le « chlore 36 », de demi vie 3,01×10 5 ans, est donc un traceur particulièrement adapté à l’étude des eaux souterraines anciennes.
Pour dater des eaux plus récentes, on peut utiliser le « carbone 14 », de demi-vie 5,73×10 3 ans, présent dans les ions carbonate CO32- (aq) dissous par exemple.
1.9.1. Loi de décroissance radioactive.
On considère un échantillon, de volume V donné, d’eau issue d’une nappe phréatique.
On note :
- N0 le nombre moyen de noyaux de « chlore 36 » présents dans cet échantillon à l’instant de date t0 = 0 s de la constitution de la nappe.
- N(t) le nombre moyen de noyaux de « chlore 36 » dans l’eau extraite aujourd’hui de cette nappe et donc non renouvelée en « chlore 36 ».
Écrire la loi de décroissance radioactive liant N(t), N0 et t1/2.
1.9.2. Datation d’une eau souterraine.
On admet que N0 est égal au nombre moyen de noyaux de «chlore 36 » présents dans un échantillon de même volume V d’eau de surface.
Déduire de la loi de décroissance écrite précédemment l’âge d’une nappe phréatique dont l’eau non renouvelée ne contient plus que 38 % du nombre de noyaux de « chlore 36 » trouvée dans les eaux de surface.
Pourquoi ne pas avoir utilisé le « carbone 14 » pour dater cette nappe phréatique ?
2. Du chlore dans l’eau de Javel
L’eau de Javel, produit courant et bon marché, est une solution aqueuse contenant entre autres des ions hypochlorite ClO–(aq) et des ions chlorure Cl–(aq). Outre ses propriétés désinfectantes (c’est un bactéricide puissant), l’eau de javel est utilisée pour son pouvoir «blanchissant», lié à l’action oxydante de l’ion hypochlorite sur de nombreux colorants.
L’eau de Javel se décompose lentement selon une transformation totale modélisée par la réaction d’équation :
réaction (1) : 2ClO–(aq) = 2 Cl–(aq) + O2 (g)
On se propose d’étudier la décomposition d’une eau de Javel.
Pour suivre l’évolution de cette transformation, on dilue une solution commerciale S0 afin d’obtenir un volume V = 250 mL d’une solution S1 d’eau de Javel dix fois moins concentrée que S0.
On verse V1 = 20,0 mL de la solution S1 dans un ballon.
À l’instant de date t0 = 0 s où l’on déclenche le chronomètre, on ajoute, sans variation de volume, une pointe de spatule de chlorure de cobalt dans la solution et on bouche le ballon. L’ion cobalt Co2+(aq) est un catalyseur de la réaction (1).
Pour suivre l’évolution de la transformation qui se déroule, on mesure, avec un dispositif adapté, la pression p du gaz dans le ballon. On néglige la quantité de dioxygène dissoute dans l’eau par rapport à la quantité de dioxygène produite. La température T est maintenue constante et le volume V0 occupé par le gaz dans le ballon est constant : T = 296 K et V0 = 275 mL
| t (min) | 0 | 1,0 | 2,0 | 3,0 | 4,0 | 5,0 | 8,0 | 11,0 | 13,0 | ... | 145 | 427 | 1308 | 1757 | 1896 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| p(t) (102 Pa) | 1020 | 1038 | 1038 | 1055 | 1063 | 1068 | 1078 | 1084 | 1086 | ... | 1103 | 1108 | 1111 | 1112 | 1112 |
La verrerie mise à disposition est en partie la suivante :
- Fioles jaugées de 50 mL, 100 mL, 200 mL, 250 mL, 500 mL ;
- Pipettes jaugées de 5 mL, 10 mL, 20 mL, 25 mL ;
- Pipettes graduées de 5 mL, 10 mL, 20 mL, 25 mL ;
- Eprouvettes graduées de 10 mL, 20 mL, 250 mL, 500 mL.
2.1. Quels matériels, pris dans la verrerie mise à disposition, doit-on utiliser pour préparer S1 ?
2.2. Avancement de la réaction
2.2.1. On note :
- n1 la quantité initiale d’ions hypochlorite dans le volume V1 de solution dans le ballon ;
- n2 la quantité initiale d’ions chlorure dans ce même volume de solution ;
- n3 la quantité initiale de dioxygène présent dans le ballon.
Compléter la dernière ligne du tableau d’évolution du système chimique, de l’annexe à rendre avec la copie (aucune application numérique n’est demandée).
2.2.2. En supposant que le dioxygène O2(g) est un gaz parfait, on montre que l’expression de l’avancement x(t) de la réaction à l’instant de date t en fonction de p(t), p(t0 = 0), T et Vo est :
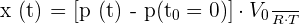
Calculer x(t1) à l’instant de date t1 = 11,0 min.
2.3. Exploitation des résultats
À partir des valeurs calculées de l’avancement x, on trace la courbe de l’annexe (à rendre avec la copie) Elle représente l’évolution, au cours du temps, de l’avancement x de la réaction qui se déroule dans le ballon.
2.3.1. Définir à l’instant de date t, par une relation littérale, la vitesse v(t) de la réaction qui a lieu dans le ballon.
2.3.2. Comment évolue v(t) au cours du temps ? Justifier la réponse, sans calcul, en utilisant le graphique.
2.3.3. Citer le facteur cinétique responsable de l’évolution de la vitesse v(t) de la réaction au cours du temps.
2.3.4. Définir le temps de demi-réaction.
2.3.5. La valeur de l’avancement final déterminée expérimentalement est xf = 1,04 x 10 – 3 mol.
En utilisant cette valeur, déterminer graphiquement une valeur approchée du temps de
demi-réaction. On fera apparaître clairement, sur la courbe de l’annexe (à rendre avec la copie), la méthode utilisée.

Annexe
Tableau d'évolution :
| Équation de la réaction | 2 ClO– (aq) = 2 Cl– (aq) + O2 (g) | |||
|---|---|---|---|---|
| État du système | Avancement (mol) | nClO- (mol) | nCl- (mol) | n02- (mol) |
| État initial | 0 | n1 | n2 | n3 |
| Au cours de la transformation | x | |||

Exercice 2 : Expériences sur un gaz à températures égales
Une mole de gaz parfait est contenue dans un cylindre dans lequel coulisse un piston. Un opérateur déplace lentement le piston. La surface extérieure du cylindre et du piston est calorifugée. Par contre, le contact thermique entre les surfaces intérieures et le gaz est parfait, c’est à dire que les températures du gaz, du cylindre et du piston sont égales, soit T.
Soient Cvm la capacité thermique molaire à volume constant du gaz, C la capacité thermique de l’ensemble cylindre + piston.
1 - Montrer que, au cours de l’évolution, pVk = Cte (évolution polytropique).
Exprimer k en fonction de Cvm, Cpm et C.
Etudier les cas où C → 0 C → ∞.
2 - Soit k = 1,30.
On donne p1 = 1 bar et T1= 20° C (état initial) : p2 = 10 bar (état final) et γ = Cpm / Cvm = 1,40
Calculer la température finale T2, W et Q reçus par le gaz.























Si vous désirez une aide personnalisée, contactez dès maintenant l’un de nos professeurs !
J’aime beaucoup.