Chapitres
- 01. Courtes définitions
- 02. Description d'un système thermodynamique
- 03. Le premier principe : un bilan énergétique
- 04. Le second principe : un principe d'évolution
- 05. Deux transformations classiques
- 06. Machines thermiques
- 07. Etudier un cas concret : le cas d'un système comportant deux corps en contact : l'évolution spontanée du système

Courtes définitions
Chaleur de réaction
Au cours d'une réaction chimique, on dit que le système échange de l'énergie avec le milieu extérieur. Cet échange se fait sous la forme de transfert thermique, anciennement appelé chaleur.
Cette énergie échangée sous forme de transfert thermique Q dépend des conditions expérimentales dans lesquelles se produit la réaction :
- Volume constant, on parle d'une transformation isochore, la thermodynamique montre que Q est égale à la variation d'énergie interne du système. On peut alors noter Qv = ΔU (c'est notamment le cas de la bombe calorimétrique)
- Pression constante, la chaleur est égale à la variation d’enthalpie : Qp = ΔH (ce qui représente le cas très fréquent des réactions effectuées à l’air libre).
Enthalpie libre
Pour tout système thermodynamique, il est défini une fonction d'état appelée enthalpie libre ou encore énergie de Gibbs. Cette fonction, notée G, est telle que G = H - TS avec :
- H l'enthalpie en joules ;
- T la température en kelvin ;
- et S l'entropie en J.K-1.
Cette fonction d'enthalpie libre est une fonction d'état considérée comme indispensable pour l'étude des équilibres chimiques. En effet, cette fonction ne peut que décroître dans le cas d'une transformation à pression et température constantes selon le deuxième principe de la thermodynamique. Cela permet donc, dans le cas d'une réaction chimique effectuée à T et P constantes, d'avoir le signe de l'enthalpie libre de réaction qui indique le sens dans lequel se déplace l'équilibre chimique. Ainsi, lorsque l'enthalpie libre atteint un minimum et donc qu'elle ne varie plus, alors l'équilibre chimique est atteint.
Les transferts thermiques

Ce qu'on appelle transfert thermique en sciences est plus couramment appelé chaleur dans la vie quotidienne. Un transfert thermique correspond à l'un des modes d'échange d'énergie thermique entre deux systèmes. Dans le cas du double vitrage, on parlera du système extérieur et du système intérieur (la maison). Cela correspond à une notion fondamentale de la thermodynamique et, contrairement au travail, les transferts thermiques correspondent à un bilan de transferts d'énergie dits microscopiques et désordonnées.
Il est possible de distinguer trois type de transfert thermique, tous pouvant coexister :
- La conduction correspond à la diffusion progressive de l'agitation thermique dans la matière ;
- La convection correspond au transfert thermique qui accompagne des déplacements macroscopiques de la matières ;
- Et le rayonnement qui correspond à la propagation de photons.
Ainsi, la quantité de chaleur, notée Q et exprimée en joule, correspond à la quantité d'énergie qui sera échangée par le moyen de ces trois différents type de transfert. Une convention indique alors que, lorsque Q > 0, on dit que le système reçoit de l'énergie. De plus, il peut être intéressant de retenir que la thermodynamique fait appel au concept de chaleur afin de mettre en place le premier mais aussi de deuxième principe de la thermodynamique.
Malgré tout cela, il reste de nombreuses ambiguïtés mais également de nombreuses confusions qui s'entretiennent. En effet, malgré le sens que l'on accorde à chaleur dans la vie quotidienne, le principe de chaleur au sens thermodynamique du mot n'a aucun lien avec la température. Cependant, il reste vrai que les transferts thermiques spontanées se font toujours du système le plus élevé en température vers le système le moins élevé en température même s'il reste possible de provoquer l'inverse grâce à une machine thermique comme un réfrigérateur.
Il est d'ailleurs intéressant de noter que, lorsqu'il y a un changement d'état, le corps pur ne changera pas de température bien qu'il échange de l'énergie sous forme de chaleur.
La thermochimie
La thermochimie correspond à une branche de la physique chimie et permet l'étude des différents phénomènes thermiques dans des milieux réactionnels. On peut positionner cette branche, sur le plan disciplinaire, à l'interface entre la chimie et la thermodynamique.
En chimie, il existe différents types de réactions : les réactions dites exothermiques et qui dégagent donc de la chaleur et les réactions dites endothermiques qui, quant à elles, absorbent la chaleur. Il est possible de déterminer et mesurer les chaleurs de réactions par calorimétrie à pression constante dans un calorimètre ou encore à volume constant dans une bombe calorimétrique.
Description d'un système thermodynamique
Pression dans un fluide
- La pression en un point d'un fluide au repos est un scalaire défini comme la force par unité de surface qu'exercent ses molécules sur une surface contenant ce point (paroi du système ou surface fictive dans le fluide).
- Unité : le pascal (Pa), unité usuelle : le bar (1 bar = 105 Pa)
- Définition cinétique de la pression
- dans un GPM : la pression est proportionnelle v*2 où v* est la vitesse quadratique moyenne des atomes, donc à leur énergie cinétique moyenne.
- La définition est conservée pour un GP quelconque mais v* est la vitesse quadratique moyenne de translation des molécules.
- p est une grandeur intensive (une grandeur est intensive si elle a la même valeur en tout point d'un système homogène)
Température
- Principe zéro de la thermodynamique : si deux systèmes sont en équilibre thermique avec un troisième, ils sont en équilibre thermique entre eux. Ces systèmes sont dits à la même température.
- Température absolue :
- Le thermomètre est une masse donnée d'un gaz quelconque.
- La grandeur thermométrique est la limite aux très faibles pressions du produit pV à température fixée. Elle est indépendante du gaz utilisé !
- Le rapport des grandeurs thermométriques est égale aux rapport des températures absolues T correspondantes.
- La température de référence permet de définir l'unité : le kelvin (K). C'est la température du point triple de l'eau : on choisit Tréf = 273,16 K.
- Définition cinétique de la température
- dans un GPM : L'énergie cinétique d'un atome est proportionnelle à sa température cinétique T.
- La définition est conservée pour un GP quelconque avec l'énergie cinétique de translation des molécules.
- Echelle Celsius : t = T -273,15
- T est une grandeur intensive.
Equation d'état des fluides
Le système considéré est formé d'une masse donnée d'un corps pur dans l'état gazeux ou liquide. L'équation d'état est une relation entre pression, volume et température.
GP
- Équation d'état du GP : pV=nRT
- On la démontre en utilisant les définitions cinétiques de T et p : on égale deux expressions de l'énergie cinétique du gaz parfait.
Gaz réels
On utilise souvent l'équation d'état de Van der Waals pour décrire les gaz réels car elle tient compte des défauts du gaz réel par rapport au gaz parfait : interactions entre molécules et volume des molécules.
Coefficients thermoélastiques
- Coefficient de dilatation isobare α :
- il indique comment varie V quand on augmente T à p fixée.
- α >0 car sauf exception (eau entre 0 et 4 °C) V augmente si on augmente T à p fixée.
- Coefficient de compressibilité isotherme ΧT :
- il indique comment varie V quand on augmente p à T fixée.
- ΧT>0 car V diminue si on augmente p à T fixée.
- Ordres de grandeur pour un gaz : α et ΧT sont proches des valeurs calculées pour un GP soit α=1/T et ΧT=1/p.
Phases condensées
Les liquides et les solides sont peu dilatables et peu compressibles d'où un modèle souvent utilisé en thermodynamique : modèle du fluide indilatable et incompressible donc de volume constant.
Le premier principe : un bilan énergétique
Résumé
Egalement appelé principe de la conservation de l'énergie, ce principe affirme que l'énergie est toujours conservée. Formulé autrement, cela signifie que l'énergie totale d'un système isolé reste constante. Ainsi, les événements qui se produisent au sein du système isolé ne se traduisent donc que par des transformations de certaines formes d'énergie en d'autres formes d'énergie. Puisque l'énergie ne peut pas être produite en partant de rien, elle est présente en quantité invariable dans la nature. Elle ne peut donc que se transmettre d'un système à un autre : on ne crée par l'énergie, on la transforme.
Ce principe est également considéré comme étant une loi générale pour toutes les théories physiques, notamment en mécanique, électromagnétisme ou physique nucléaire puisqu'on ne lui a jamais trouvé la moindre exception même si des doutes peuvent subsister lorsque l'on étudie les désintégration radioactives.
De puis le théorème de Noether, on sait que la conservation de l'énergie est intimement reliée à une uniformité de structure de l'espace-temps.
Le premier principe de la thermodynamique rejoint alors le célèbre principe popularisé par Lavoisier : "Rien ne se perd, rien ne se crée, tout se transforme."

Enoncé : principe de l'état initial et de l'état final
- Pour tout système thermodynamique, on peut définir une fonction d'état extensive U, énergie interne, telle que dans toute transformation d'un système fermé, la variation de U+Ec macro du système soit égale à l'énergie reçue par ce système de la part du milieu extérieur sous forme de travail W ou de transfert thermique Q : ΔU+ΔEc=W+Q
- W est un travail macroscopique, perceptible par un observateur tandis que Q est une énergie fournie au système au niveau microscopique, lors de chocs.
- U extensive : une grandeur g est extensive si sa valeur pour la réunion de deux systèmes disjoints est égale à la somme des valeurs de g des deux systèmes.
- Unité : joule (J)
- "U ne dépend pas du chemin suivi."
- Cas d'une transformation élémentaire : distinguer la notation différentielle df, "petite variation" de la fonction f (exemples : dT, dU, ...) et la notation δg qui signifie "petite quantité" de la grandeur g (exemples : δW, δQ, ...).
- Cas particuliers
Travail des forces de pression
- dans une transformation élémentaire
- dans une transformation finie
- cas d'une transformation monobare
- cas d'une transformation quasi-statique avec équilibre mécanique
- représentation graphique du travail des forces de pression en terme d'aire
- cas où Wp est nul :
- le travail des forces de pression est nul dans une détente dans le vide
- le travail des forces de pression est nul dans une transformation isochore (sans déplacement de paroi) donc la variation d'énergie interne est égale au transfert thermique reçu : Q = ΔU
Enthalpie
- définition : H = U + pV
- Unité : joule
- Dans une transformation monobare entre deux états d'équilibre mécanique entre le système et son milieu extérieur, le transfert thermique Q est égal à la variation de l'enthalpie du système : Q = ΔH. Ce résultat est très utile en chimie !
- La propriété reste bien-sûr vérifiée si la transformation est isobare (hypothèse plus forte que monobare + pi = pf = pext)
Capacités thermiques
- Le système considéré est formé de n mol d'un corps pur monophasé et n'est soumis qu'aux forces de pression.
- Définitions des capacités thermiques isochore Cv et isobare Cp.
- dU=CvdT dans une transformation isochore et dH=CpdT dans une transformation isobare.
Cas du GP
- Le GP vérifie la première loi de Joule (U ne dépend que de T)
- Pour un GP, dU=CvdT et dH=CpdT valable pour une transformation quelconque.
- Relation de Mayer : Cp-Cv=nR.
- Cvm=3/2.R pour le GP monoatomique.
- Cvm=5/2.R pour le GP diatomique aux températures usuelles.
Cas des phases condensées
- On utilise fréquemment le modèle du corps indilatable et incompressible.
- Dans ce cas : U = H, fonction de T seulement et Cv = Cp = C = n.c
- dU = CdT = dH pour une transformation quelconque.
Le second principe : un principe d'évolution
Résumé
Egalement appelé principe d'évolution des système, ce principe affirme la dégradation de l'énergie. En effet, l'énergie d'un système passe de façon nécessaire et spontanée de formes concentrées et potentielles à des formes diffuses et cinétiques telles que le frottement ou la chaleur.
Ce principe introduit donc également la notion d'irréversibilité d'une transformation et la notion d'entropie. En effet, d'après le deuxième principe de la thermodynamique, l'entropie d'un système isolé augmente ou reste constante. Souvent interprété comme une mesure du désordre et comme l'impossibilité du passage du désordre à l'ordre sans intervention extérieur.
L'interprétation de ce principe se base sur la théorie de l'information de Claude Shannon et la mesure de cette information, également appelée entropie de Shannon.
La principale différence de ce principe avec le premier principe de la thermodynamique est l'origine statique de ce deuxième principe. En effet, les lois microscopiques qui gouvernent la matière ne le contiennent qu'implicitement et de manière statique. Cependant, le deuxième principe de la thermodynamique reste relativement indépendant des caractéristique des lois précédemment citée puisqu'il apparaît même si l'on suppose des lois simplistes à petite échelle.
Enoncé : introduction de l'entropie
- A tout système thermodynamique, on peut associer une fonction d'état extensive S, appelée entropie, telle que si le système est fermé :
- Dans toute transformation adiabatique S ne peut qu'augmenter.
- Dans une transformation quelconque, la variation de S est la somme de l'entropie échangée Se et de l'entropie créée Sc.
- La transformation est réversible si et seulement si Sc est nulle, la transformation est irréversible si et seulement si Sc est strictement positive.
- L'entropie échangée lors d'une étape élémentaire au cours de laquelle le système reçoit le transfert thermique δQ est définie par δQ/\text.
- Expressions de Se
- Unité J/K
- Un système fermé isolé thermiquement évolue spontanément et irréversiblement tant que son entropie peut augmenter. A l'équilibre S est maximale compte tenu des contraintes imposées au système.
- Inégalité de Clausius
Les autres principes de base de la thermodynamique
Le principe zéro de la thermodynamique
Ce principe concerne la notion d'équilibre thermique. Ainsi, il est à la base de la thermométrie et s'énonce ainsi : si deux systèmes sont en équilibre thermique avec un troisième, alors ils sont aussi ensemble en équilibre thermique.
Le troisième principe de la thermodynamique
Ce principe, quant à lui, est associé à la descente vers un état quantique fondamental d'un système dont la température s'approche d'une limite qui définit la notion de zéro absolu. En effet, en thermodynamique classique, ce principe permet de calculer l'entropie molaire S d'un corps pur par intégration sur la température à partir de S=0 à 0 K dans le but d'établir des tables de données thermodynamiques.
La loi de Laplace en thermodynamique
En thermodynamique, cette loi correspond à une relation reliant la pression et le volume d'un gaz parfait qui subit une transformation dite isentropique ou une transformation dite adiabatique et réversible. Mais cette relation peut également être utilisée avec la température et le volume ainsi que la température et la pression.
La loi de Laplace suppose en effet des capacités thermiques constante alors que les capacités thermiques d'un gaz parfait dépend évidemment de la température, il suffit de regarder la loi des gaz parfait. En conséquence, cette loi ne peut être appliquée à des transformation où la variation de la température est peu important. On peut alors considérer que les capacités thermiques sont constantes.

Avec :
- P est la pression d'un gaz (en pascals) ;
- V le volume occupé par le gaz (en m3) ;
- n la quantité de matière (en moles) ;
- R la constante universelle des gaz parfaits (8,3144621 J/K/mol) ;
- Et T est la température (en kelvins).
Identités thermodynamiques
Système : masse donnée d'un corps pur sous une phase
- Définitions thermodynamiques de T et p
- T et p ainsi définis s'identifient aux grandeurs usuelles.
- Identités thermodynamiques dU = TdS - pdV et dH = TdS + Vdp
- (S,V) sont les variables naturelles de U(S,p) sont les variables naturelles de H
"ΔS est indépendante du chemin suivi"
- Lien entre transfert thermique et variation d'entropie pour une transformation réversible
- Intérêt pour calculer une variation d'entropie dans une transformation quelconque
Variation d'entropie de systèmes usuels
Méthode : on égale l'expression de dU ou dH utilisant une capacité thermique et celle issue de l'identité thermodynamique.
- GP
- Gaz de Van der Waals
- Phase condensée
- Thermostat
Interprétation statistique de l'entropie
- L'entropie mesure le désordre.
- Définition : S = k ln Ω où Ω est le nombre d'états accessibles par le système.
- Tous les états accessibles d'un système sont équiprobables
Deux transformations classiques

Détente de Joule Gay-Lussac : détente adiabatique dans le vide
- Description
- L'énergie interne du gaz est constante dans la détente de Joule Gay-Lussac.
- Conséquence : la température d'un gaz vérifiant la première loi de Joule ne varie pas dans cette transformation.
Détente de Joule Thomson : détente adiabatique avec écoulement
- Description
- L'enthalpie d'une masse donnée de fluide est conservée lors de la détente de Joule Thomson
- Conséquence : la température d'un gaz vérifiant la seconde loi de Joule ne varie pas dans cette transformation.
Machines thermiques
Les différentes machines thermiques
- Principe général d'une machine thermique : le système (l'agent thermique) subit des cycles. Au cours de chaque cycle, il reçoit de la part du milieu extérieur un travail W et des transferts thermiques Qi de la part de thermostats (ou sources de chaleur) à Ti.
- La machine est
- un moteur si elle fournit du travail,
- une machine frigorifique de type réfrigérateur si elle prélève un transfert thermique à une source froide,
- une machine frigorifique de type pompe à chaleur si elle fournit un transfert thermique à une source chaude.
- Pour un moteur, on calcule le rendement r, pour une machine frigorifique, on calcule l'efficacité e. Dans les deux cas, c'est le rapport de ce qui est récupéré sur ce qui est dépensé.
- Les conséquences des principes pour les cycles :
- 1er principe W + ΣQi = O
- 2nd principe (inégalité de Clausius des cycles) Σ(Qi /Ti ) <0 si le cycle est irréversible et égal à 0 si le cycle est réversible.
Machines dithermes
- Moteur :
- Sens des transferts thermiques : apport thermique par la source chaude et rejet thermique dans la source froide.
- Théorème de Carnot : r est inférieur ou égal au rendement de Carnot rC = 1-Tf/Tc, ce rendement étant obtenu uniquement si le cycle est réversible.
- Réfrigérateur et pompe à chaleur :
- Ce sont des récepteurs.
- Sens des transferts thermiques : prélèvement thermique à la source froide et rejet thermique dans la source chaude.
- Dans les deux cas : la "dépense" est le travail reçu.
- Pour le réfrigérateur, la "recette" est le transfert thermique prélevé à la source froide.
- Pour la pompe à chaleur, la "recette" est le transfert thermique rejeté dans la source chaude.
- Dans les deux cas, l'efficacité est majorée par celle obtenue si le cycle est réversible.
Premier principe dans un écoulement stationnaire
- formulation adaptée du 1er principe à un fluide en écoulement stationnaire dans une machine : h2-h1 = wu + q
L'écoulement laminaire
Quand on parle d'écoulement laminaire en mécanique des fluides, on évoque le mode d'écoulement d'un fluide dans le cas où l'ensemble du fluide s'écoule plus ou moins dans la même direction et cela sans que les différences locales ne se contrarient. On est alors en opposition au régime turbulent au cours duquel l'écoulement produit des tourbillons qui vont mutuellement se contrarier.
Ainsi, lorsque l'on cherche à faire circuler un fluide dans un tuyau, on cherche à mettre en place un écoulement laminaire afin qu'il y ait moins de pertes de charge. Mais on cherche aussi à mettre en place un écoulement laminaire lorsque l'on cherche à faire voler un avion afin que le vol soit stable et prévisible à l'aide d'équations.
L'écoulement laminaire d'un point de vue microscopique
Il est toujours intéressant d'apporter un point de vue microscopique à une réflexion. en effet, alors que rien ne se voit d'un point de vue macroscopique, il peut se passer beaucoup de chose dans le monde du très petit.
Lorsque l'on observe un écoulement laminaire à l'échelle microscopique, on peut observer que deux particules de fluides qui sont voisines à un instant défini resteront voisines lors des prochains moments d'observation. Par cette observation, on peut décrire un champ de vitesse grâce à l'utilisation de techniques classiques d'analyse mathématique.
Dans le cas où l'écoulement devient turbulent, celui-ci devient alors sans organisation apparente. Les techniques classiques d'analyse mathématique utilisées précédemment ne suffisent alors plus pour décrire le champ de vitesse.
L'écoulement laminaire d'un point de vue macroscopique
Tout comme la notion de régime turbulent, la notion de régime laminaire est très fortement liée à la viscosité du fluide en mouvement. En effet, lorsque le liquide se situe dans une conduite ou autour d'un obstacle, alors, au voisinage d'une paroi sur laquelle la vitesse relative du fluide est nulle, on peut alors observer l'apparition de fortes variations de vitesse au sein desquelles la viscosité est impliquée.
De façon plus précise, on peut dire que l'écoulement visqueux est caractérisé grâce à un nombre sans dimension que l'on appelle le nombre de Reynolds. Ce nombre permet alors de mesurer l'importance relative des forces inertielles qui sont liées à la vitesse et des forces de frottement qui sont liées à la viscosité.
Ainsi, si ces dernières sont prépondérantes, alors on peut dire que le frottement, qui se produit entre deux couches de fluides, maintient leur cohésion : on obtient ainsi un écoulement laminaire.
Dans le cas où le nombre de Reynolds augmente au-delà d'un certain seuil, alors l'écoulement est déstabilisé. Dans ce cas, il peut y avoir un régime turbulent qui va se mettre en place après qu'une phase de transition, plus ou moins importante, ait eu lieu.
Le nombre de Reynolds, noté Re, correspond à un nombre sans dimension qui est utilisé en mécanique des fluides. Cette grandeur permet alors de caractériser un écoulement, en particulier la nature de son régime. Il est ainsi possible de savoir si un écoulement est laminaire, transitoire ou turbulent.
Etudier un cas concret : le cas d'un système comportant deux corps en contact : l'évolution spontanée du système
Si on considère A et B comme deux objets indéformables (donc δW = 0) qui forment à eux deux un système isolé (donc δQ = 0). Ainsi, si on se réfère au premier principe de la thermodynamique, on peut affirmer que la variation de l'énergie interne est égale à la somme de la chaleur et du travail. On a donc :

Ainsi, si on considère δQA et δQB comme étant les énergie thermiques élémentaires échangées entre l'objet A et l'objet B, on a donc : 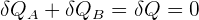
Et donc : 
Ensuite, si on suit le deuxième principe de la thermodynamique, il est possible d'écrire la relation suivante permettant de faire le lien entre les entropie des objets A et B :
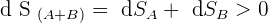
De plus, puisqu'il est indiqué que le système étudié est isolé, on sait par définition que : 
De ce fait, on a 
On peut alors en déduire que 
Ainsi, si δQA < 0 et donc que δQB > 0, alors on a TA > TB. De ce fait, en utilisant la règle des signes, on peut en conclure que l'objet A cède de la chaleur à l'objet B. On peut donc en conclure que l'objet le plus chaud cède de la chaleur à l'objet le plus froid.
Pour résumer la situation, dans le cas simple mettant en jeu un transfert thermique entre deux corps en contact avec des températures différentes, ce sera toujours le corps le plus chaud qui cédera de l'énergie thermique au corps le plus froid par conduction. Suite à cela, sa température va diminuer tout comme le désordre et l'agitation thermique. Cependant, pour le corps froid, la température et l'agitation thermique vont augmenter.
L'exemple le plus simple de situation mettant en jeu un transfert thermique est celui de deux corps en contact ayant des températures différentes. Le corps le plus chaud cède de l'énergie au corps le plus froid par conduction ; sa température diminue, le désordre, l'agitation thermique, diminue. En contrepartie, la température du corps froid augmente, l'agitation thermique augmente en son sein.























Si vous désirez une aide personnalisée, contactez dès maintenant l’un de nos professeurs !