Chapitres
La technique de chromatographie sur colonne repose sur le même principe que la chromatographie sur couche mince : les espèces chimiques à séparer sont plus ou moins entraînées par un éluant sur une phase fixe :
- La phase fixe est un solide, le plus souvent de la silice ou de l'alumine remplissant une colonne.
- L'échantillon est déposé en haut de la colonne. La séparation des espèces chimiques est obtenue par l'écoulement continu d'une phase mobile ( l'éluant ) à travers la colonne.
La séparation est basée sur une différence de vitesses d'entraînement des espèces chimiques vers le bas de la colonne. L'objectif de ce TP est donc de séparer les constituants colorés d'un sirop de menthe ( colorants alimentaires : le E102 et le E131 ) puis de montrer l'intérêt de la chromatographie sur colonne vis ) vis de la chromatographie sur couche mince.
Il existe plusieurs chromatographies.
En voici des exemples :
La chromatographie permet de séparer et d'identifier les espèces chimiques d'un mélange. Elle est basée sur leur différence d'affinité pour deux phases : la phase stationnaire, ou phase fixe et la phase mobile appelée éluant et constituée d'un mélange de solvants.
Chromatographie d'adsorption
La chromatographie sur couche mince (CCM) et la chromatographie sur colonne sont des chromatographies d'adsorption ; elles sont basées sur la différence d'adsorption sur la phase stationnaire ; des espèces à séparer entraînées par l'éluant. La phase stationnaire est solide (silice ou alumine).
Chromatographie de partage
La chromatographie sur papier est une chromatographie de partage basée sur la différence de solubilité des espèces à séparer. La phase stationnaire est formée par l'eau liée aux molécules de cellulose du papier.
Rapport frontal
Le rapport frontal Rf est une caractéristique d'une espèce chimique, dans un éluant donné et sur un support donné. Il est défini par :
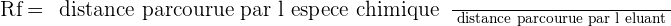

La chromatographie pour vérifier une extraction chimique
La technique la plus utilisée : l'extraction par hydrodistillation
Une hydrodistillation ou entraînement à la vapeur d'eau est la distillation d'un mélange d'eau et d'un liquide organique.
Elle consiste à porter à ébullition le mélange, puis à condenser les vapeurs qui se dégagent afin de récupérer les arômes. La distillation obtenue contient deux phases :
- Une phase organique : l'huile essentielle.
- Une phase aqueuse : l'eau.
Pour récupérer l'huile essentielle, on recourt à une extraction liquide-liquide.

Description du principe
Dans un entraînement à la vapeur ou hydrodistillation, on fait bouillir un mélange d'eau et de produit à extraire, puis on liquéfie la vapeur dans un réfrigérant. La solution obtenue s'appelle le distillat.
Le but de cette technique est de récupérer les essences d'épices, de fleurs, de fruits ou des plantes.
Où trouver un cours physique chimie ?
Les étapes de l'hydrodistillation
Etape 1 : Extraction de l'huile essentielle d'orange
En se vaporisant, l'eau entraîne avec elles les huiles essentielles contenues dans le produit brut (clou de girofles, écorces d'oranges, lavande…). Les vapeurs arrivent dans le réfrigérant où la température est de l'ordre de 15°C.Elles se liquéfient dans l'éprouvette graduée.
Remarque : Le distillat obtenu en TP n'a qu'une seule phase puisqu'on extrait trop peu d'huile essentielle qui s'est solubilisée dans l'eau. On aurait extrait plus d'huile essentielle du zeste d'orange nous aurions alors obtenu deux phases puisque l'huile essentielle d'orange est faiblement soluble dans l'eau.
Où trouver des cours de physique chimie 5ème ?
Etape 2 : Le relargage
Le relargage consiste à rendre des composés organiques (huile essentielle...) moins solubles dans l'eau en ajoutant du chlorure de sodium qui n'est autre que du sel. Après le relargage l'extraction sera donc plus facile.
Pour ce faire on place le distillat dans une ampoule à décanter et l'on rajoute de l'eau salée. On agite, dégaze et on laisse décanter. Cette étape permet ainsi de mieux séparer l'huile essentielle de la phase aqueuse puisque l'huile essentielle est moins soluble dans l'eau salée que dans l'eau.
On peut s'arrêter ici et récupérer l'huile essentielle à l'aide de l'ampoule à décanter.
Etape 3 : Extraction par solvant
On choisit le cyclohexane comme solvant extracteur puisqu'il est non miscible avec l'eau salée et que l'huile essentielle d'orange est très soluble dans le cyclohexane.
Le distillat étant déjà dans l'ampoule à décanter avec l'eau salée, nous rajoutons le cyclohexane. Nous agitons, dégazons et laissons décanter. Tout l'huile essentielle contenue dans la phase aqueuse passe dans la phase organique puisque l'huile essentielle est très soluble dans le cyclohexane. Il se forme également deux phases puisque le cyclohexane est non miscible avec l'eau salée. La densité du cyclohexane (=0,78) étant plus faible que celle de l'eau salée (=1,1) la phase surnageante est la phase organique contenant l'huile essentielle d'orange et le cyclohexane, quant à la phase sous-nageante il s'agit de la phase aqueuse contenant de l'eau salée.
L'utilisation de l'ampoule à décanter permet de séparer les deux phases en laissant s'écouler les liquides jusqu'à leur surface de séparation. Ainsi on introduit dans un premier temps la phase aqueuse sous-nageante dans un bécher et la phase organique surnageante dans un autre bécher. La phase aqueuse ne nous est pas utile, on s'en débarrasse.
En revanche, nous allons traiter la phase organique qui contient entre autres l'huile essentielle d'orange qui nous intéresse.
Etape 4 : Séchage
Maintenant nous allons "sécher" la phase organique. Bien que l'eau soit non miscible avec le cyclohexane il y a toujours des traces d'eau(très peu) dans le cyclohexane. Pour éliminer cette eau on utilise des grains de sulfate de magnésium anhydre (poudre) qui vont emprisonnés les molécules d'eau. Une fois la poudre introduite dans la phase organique il ne reste plus qu'à filtrer le sulfate de magnésium.
Le filtrat ainsi obtenu est la phase organique contenant le cyclohexane et l'huile essentielle d'orange. Quant à l'eau, elle est enfermée dans les grains de sulfate de magnésium qui ont été filtrés au niveau du papier filtre.
Etape 5 : Distillation
Le solvant extracteur employé à pour propriété d'avoir une température d'ébullition faible, ainsi en évaporant(distillation) le solvant organique volatil (cyclohexane) nous obtenons l'huile essentielle qui a été si difficile à extraire.
L'inconvénient reste la faible quantité d'huile essentielle récupérée au final, c'est en partie cela qui explique le prix élevé des parfums.
Méthode de chromatographie sur colonne
Voici un exemple de méthode de chromatographie sur colonne, la séparation des colorants alimentaires d'un sirop de menthe.
Séparation des colorants alimentaires d'un sirop de menthe
I : Préparation de la colonne
L'opération de remplissage de la colonne conditionne l'efficacité de la séparation. Il ne faut pas qu'il y ait de bulles ou de zone sans phase stationnaire car on aurait alors des chemins préférentiels nuisant à une bonne séparation des composés. Pendant la phase d'élution avec le solvant, on veillera également à ne pas assécher la partie supérieure de la phase fixe.
- Fixer verticalement la colonne à l'aide d'une pince.
- Déposer un petit morceau de coton dans le bas de la colonne.
- Déposer un peu de sable pour rendre la surface plane.
- Peser environ 5g de silice et délayer dans l'eau salée pour en faire un gel.
- Introduire la silice dans la colonne.
- Tapoter la colonne afin d'obtenir une surface plane de silice : rajouter un peu de sable pour aplanir.
- Placer un bêcher sous la colonne.
8 : Introduire doucement de l'eau salée ( à l'aide d'une pipette plastique par écoulement de long de la paroi de la colonne ). Ajouter une quantité d'eau suffisante pour être environ à 2 cm au dessus de la surface plane de la silice.
II : Dépôt de l'échantillon à préparer
- Déposer très doucement à l'aide d'une pipette, sans toucher les parois de la colonne, 5 gouttes de sirop de menthe : attention à ne pas déformer la surface de la phase stationnaire pendant cette opération.
- Lorsque le sirop de menthe a pénétré la surface de la phase stationnaire, éluer avec l'eau salée en remplissant la colonne doucement à la pipette plastique.
- Lorsque le premier colorant arrive en bas de la colonne le récupérer dans un premier erlenmeyer.
- Éluer ensuite avec un autre éluant : alcool à 95°.
- Lorsque le second colorant parvient en bas de la colonne, le récupérer dans un second erlenmeyer.
REMARQUE : Un bêcher « poubelle » doit vous servir à récupérer les liquides indésirables.
Analyse spectrophotométrique des colorants
À l'aide d'un spectrophotomètre, on souhaite tracer les spectres d'absorption A = f( lambda ), du sirop de menthe et des 2 colorants issus de la séparation précédente.
Une dilution des solutions obtenues est nécessaire pour ne pas dépasser la valeur maximale mesurable par le spectrophotomètre.

Réalisation des mesures :
- Le réglage du zéro se fera sur de l'eau distillée en transmittance ( 100% ). Passer ensuite en absorbance.
- Il est indispensable de faire le banc pour toutes les longueurs d'ondes.
- On fait varier la longueur d'onde entre 400 et 720 nm en relevant les valeurs de l'absorbance tous les 10 nm ou 20 nm et en rentrant les valeurs au fur et à mesure dans le tableau ci-dessous. Vous allez créer ce tableau dans le tableur-grapheur (type Excel). On créera pour cela les variables « lambda », « Av », « Aj » et « Ab » puis on rentrera au clavier les valeurs mesurées.
| λ (nm) | 400 | 420 | 440 | 460 | 480 | 500 | 520 | 540 | 560 | 580 | 600 | 620 | 640 | 660 | 680 | 700 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Aj | 1,17 | 1,31 | 1,24 | 0,79 | 0,24 | 0,03 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Ab | 0,22 | 0,17 | 0,14 | 0,12 | 0,1 | 0,09 | 0,1 | 0,11 | 0,15 | 0,22 | 0,29 | 0,48 | 0,56 | 0,23 | 0,04 | 0,01 |
| Av | 1,67 | 1,88 | 1,8 | 1,56 | 0,4 | 0,05 | 0,01 | 0,03 | 0,08 | 0,17 | 0,24 | 0,45 | 0,54 | 0,2 | 0 | 0 |
Tracer à l'aide de l'assistant graphique, les 3 courbes sur le même diagramme. Interpréter les courbes obtenues. Sont-elles conformes à ce que l'on pouvait prévoir ? Interpréter chacune d'elle.
On remarque que la courbe correspondant au jaune et celle correspondant au bleu possède seulement un pic : on détermine ainsi leur longueur d'onde et leur couleur par la même occasion. Celle correspondant au vert possède quand à elle, deux pics situés aux mêmes endroits que ceux du jaune et du bleu. On en déduit que le vert est un composé de bleu et de jaune.

Entrainement
Quelques questions
Sur la méthode que nous venons de voir, voici quelques questions qui vous aideront à vérifier que vous avez bien compris le principe.
1 : Quelle est la phase stationnaire ? Quelle(s) est(sont) la(les) phase(s) mobile(s) ?
La phase stationnaire correspond au gel de silice. Les deux phases mobiles sont les deux éluants ( eau salée + alcool à 95° ).
2 : Quelle est la couleur du premier colorant extrait ? Proposer une méthode pour l'identifier.
Le premier colorant extrait est le jaune ( E102 ). On pourrait mesurer l'absorbance à l'aide d'un spectrophotomètre.
3 : Le deuxième colorant est le E131. Quelle est sa couleur ?
Le E131 correspond au colorant bleu.
4 : Quel est le colorant qui est le plus adsorbé par le gel de silice ?
Le colorant le plus adsorbé par le gel de silice est le bleu ( E131 ).
5 : Quel est celui qui présente le plus d'affinité avec l'eau salée ?
Celui qui présente le plus d'affinité avec l'eau salée est le jaune ( E102 ).
6 : Pourquoi avoir changé d'éluant pendant la chromatographie ?
Le bleu ne présentait aucune affinité avec l'eau salée. Nous ne serions ainsi pas parvenu à l'extraire correctement.
7 : Quel est l'intérêt de ce type de chromatographie par rapport à celle sur couche mince ?
Le type de chromatographie sur colonne permet de récupérer les deux colorants. Celle sur CCM les sépares simplement.
Exercice de type BAC : Traitement d'une infection virale
Pour une infection provoquée par le virus Influenza, deux types de traitements peuvent être prescrits aux patients : les traitements symptomatiques tels que les antipyrétiques (paracétamol, ibuprofène, …) et les traitements antiviraux (oséltamivir, zanamivir,…)
Dans un laboratoire, on reçoit deux comprimés : l’un étant de l’ « ibuprofène 100 mg » et l’autre de l’« oséltamivir 75 mg ». Ces médicaments contiennent un principe actif différent et d’autres espèces chimiques appelées excipients. Le principe actif est l’espèce chimique utile au traitement. Par exemple, pour le comprimé « ibuprofène 100 mg », il s’agit de l’ibuprofène.
Dans cet exercice on se propose de vérifier l’identité des deux comprimés, puis de réaliser le dosage
pH-métrique de l’ibuprofène et enfin d’étudier quelques propriétés de l’oséltamivir.

1. Identification des comprimés d’ibuprofène et de l’oséltamivir
1.1. Analyse chromatographique
On réalise une chromatographie sur couche mince des deux comprimés reçus que l’on nomme arbitrairement A et B. L’éluant est un mélange complexe de solvants organiques.
Identifier, en justifiant les réponses, les deux comprimés A et B à partir du chromatogramme représenté en figure 1.
Dépôt 1 : principe actif du comprimé A
Dépôt 2 : principe actif du comprimé B
Dépôt 3 : ibuprofène de référence
Dépôt 4 : « oséltamivir » de référence
1.2. Principe actif
Données :
- Masse molaire de l’ibuprofène : Mi = 206 g.mol–1 ;
- Masse molaire de l’oséltamivir : Mo = 312 g.mol–1 .
1.2.1. La masse du comprimé d’ «ibuprofène 100 mg » est de 300 mg. Celle du comprimé d’« oséltamivir 75 mg » est de 225 mg. Expliquer la différence entre les masses annoncées et les masses mesurées.
1.2.2. Déterminer la quantité de matière de principe actif contenu dans le comprimé
d’ «ibuprofène 100 mg ».
1.2.3. Calculer la masse d’oséltamivir correspondant à la même quantité de matière.
1.2.4. Les deux comprimés contiennent-ils la même quantité de matière de leur principe actif ? Justifier.
2. Dosage pH-métrique de l’ « ibuprofène »
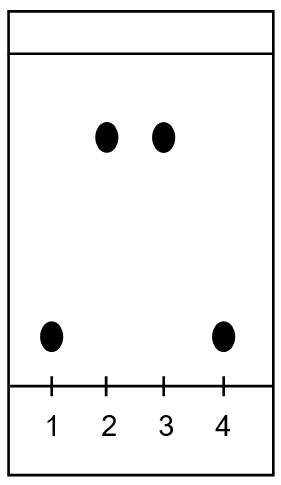
On souhaite vérifier la masse d’ibuprofène présente dans un comprimé. L’ibuprofène a été synthétisé pour la première fois dans les années 1960. Sa formule correspond à la figure 2.
2.1. Préparation de la solution aqueuse d’ibuprofène
On broie puis on dissout le comprimé contenant l’ibuprofène dans 30 mL d’éthanol. Les excipients y sont insolubles. On filtre alors sous vide le mélange. Le filtrat, contenant l’ibuprofène dissous, est dilué dans 70 mL d’eau. On obtient une solution S d’ibuprofène dont on admet qu’elle a le même comportement qu’une solution aqueuse.
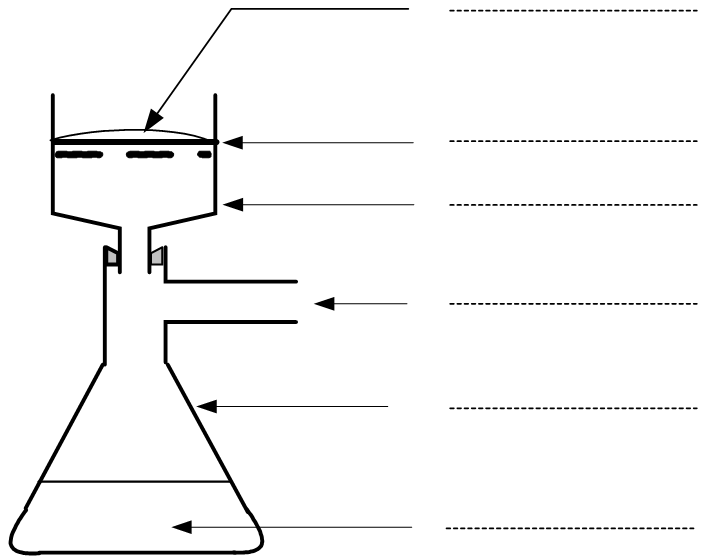
2.1.1. En utilisant les mots contenus ci-dessous, légender le schéma de la FIGURE 3 DE L’ANNEXE.
- Filtrat ;
- Fiole à vide ;
- Papier filtre ;
- Entonnoir Büchner ;
- Excipients solides ;
- Vers la trombe à vide.
2.1.2. Expliquer pourquoi la filtration sous vide est préférée à la filtration simple.
2.2. Réalisation du dosage pH-métrique de l’ibuprofène
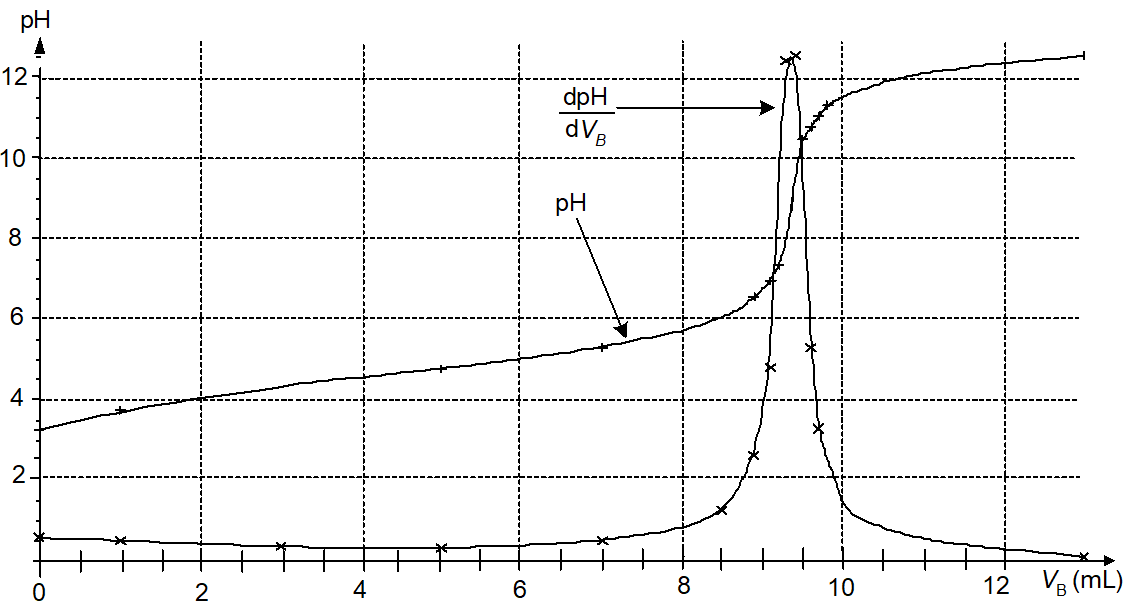
On dose l’ibuprofène contenu dans la solution S à l’aide d’une solution aqueuse d’hydroxyde de sodium (Na+ + HO–) de concentration en soluté apporté cB = 5,00 ´ 10–2 mol.L–1. La mesure du pH permet de tracer les courbes de la FIGURE 4 DE L’ANNEXE.
2.2.1. À l’aide de la formule de l’ibuprofène (figure 2), expliquer pourquoi il est possible de doser la solution S par une solution d’hydroxyde de sodium.
2.2.2. On note l’ibuprofène AH. Écrire l’équation de la réaction support du dosage.
2.2.3. À l’aide du graphique de la FIGURE 4 DE L’ANNEXE, justifier qu’aux erreurs de mesure près, le volume versé à l’équivalence est VBE = 9,4 mL.
2.2.4. Parmi les propositions ci-dessous, choisir, en le justifiant, l’expression littérale correcte pour déterminer la masse effective m d’ibuprofène dans le comprimé où Mi est la masse molaire de l’ibuprofène.

2.2.5. Calculer la masse effective m d’ibuprofène dans le comprimé et conclure.
3. Propriétés de l’oséltamivir
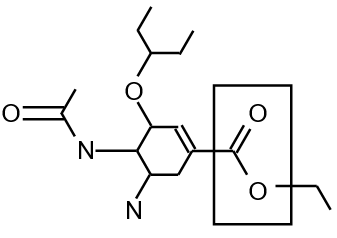
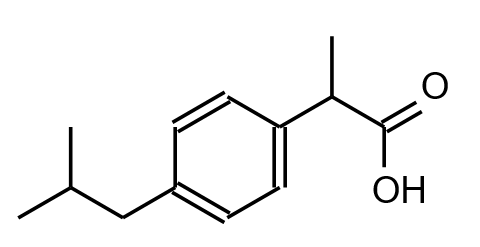
L’oséltamivir a été développé vers 1995. Sa formule semi-développée correspond à la figure 5.
3.1. Groupes caractéristiques
3.1.1. Nommer le groupe caractéristique encadré.
3.1.2. Donner la formule semi-développée du groupe R2.
3.2. Transformation chimique de l’oséltamivir
L’oséltamivir, une fois ingéré, est transformé par une enzyme en ion carboxylate ; celui-ci agit alors sur le virus. On admet que l’enzyme joue le même rôle que l’ion hydroxyde HO– sur le groupe caractéristique encadré.
3.2.1. Écrire la réaction entre l’oséltamivir et l’ion hydroxyde.
3.2.2. Comment nomme-t-on cette réaction ?
3.2.3. Donner les deux caractéristiques de la réaction chimique précédente.
3.3. Première étape de la synthèse de l’oséltamivir
En 2005, il a été révélé que l’oséltamivir était produit à partir de l’acide shikimique (voir figure 6) contenu dans la badiane chinoise, aussi appelée anis étoilé et cultivée dans le sud de la Chine. Cet acide, qui ne présente aucune activité antivirale, subit de multiples transformations avant de devenir l’oséltamivir. La première étape est une estérification entre l’acide shikimique et l’éthanol.
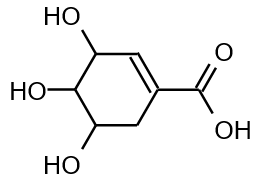
3.3.1. Caractéristiques d’une estérification
a. Écrire l’équation de la réaction d’estérification entre l’acide shikimique et l’éthanol, en formule semi-développée.
b. Citer deux caractéristiques de cette réaction d’estérification.
3.3.2. Synthèse de l’ester
On dissout 200 mg d’acide shikimique dans 10 mL d’éthanol et on ajoute quelques gouttes d’acide sulfurique, ainsi que quelques grains de pierre ponce. On chauffe à reflux le mélange réactionnel.
a. Parmi les trois propositions ci-dessous, choisir le schéma correct correspondant au protocole décrit :

a. Quel est le rôle du réfrigérant à eau ?
b. Quel est l’intérêt de chauffer le mélange réactionnel ?
c. Quel est l’intérêt d’ajouter de l’acide sulfurique ?
3.3.3. Rôles de l’éthanol
a. Parmi les propositions ci-dessous, choisir la (ou les) réponse(s) correcte(s) relative(s) au(x) rôle(s) joué(s) par l’éthanol :
A. catalyseur
B. réactif
C. solvant
b. Quel est l’intérêt d’utiliser l’éthanol en excès sur l’état d’équilibre du système ?
c. Une réaction est-elle possible entre deux groupes caractéristiques de deux molécules d’acide shikimique ? Justifier.
Annexes à compléter
Exercice de type BAC : La 5ème saveur
Il existe une autre saveur que le salé, le sucré, l’acide et l’amer : l’umami. Cette saveur a été découverte au début du XXe siècle par le professeur japonais Kikunae Ikeda.
Ce mot, contraction de "umai" (délicieux) et "mi" (goût), se traduit littéralement par "goût délicieux". Le secret de l'effet umami tient en trois acides aminés : les acides glutamique, guanylique et inosinique. Ces espèces chimiques, naturellement présentes dans certaines viandes, légumes, poissons, crustacés et dans les aliments fumés, fermentés ou vieillis, sont responsables de cette sapidité* qui fait "wizz" en bouche.
*Sapidité : qualité de ce qui a de la saveur

Données

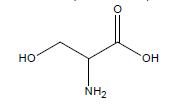
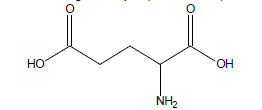
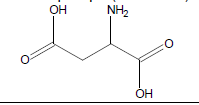
Table simplifiée de données pour la spectroscopie infrarouge :
| Liaison | Nombre d’onde (cm-1) |
|---|---|
| O-H alcool lié | 3200-3400 |
| N-H amine | 3100-3500 |
| C-H | 2800-3000 |
| O-H acide carboxylique | 2500-3200 |
| C=O | 1600-1820 |
| N-H amine ou amide | 1560-1640 |
Electronégativité de certains éléments :
| Élément | Hydrogène (H) | Carbone (C) | Azote (N) | Oxygène (O) |
|---|---|---|---|---|
| Numéro atomique Z | 1 | 6 | 7 | 8 |
| Électronégativité χ | 2,2 | 2,5 | 3,0 | 3,4 |
L’acide glutamique
1.1 L’acide glutamique est l’une des espèces chimiques qui participent à la saveur « umami ». Justifier que l’acide glutamique est un acide aminé.
1.2 Dans le tableau ci-dessous, on donne trois représentations de CRAM (notées A, B et C) de l’acide glutamique :
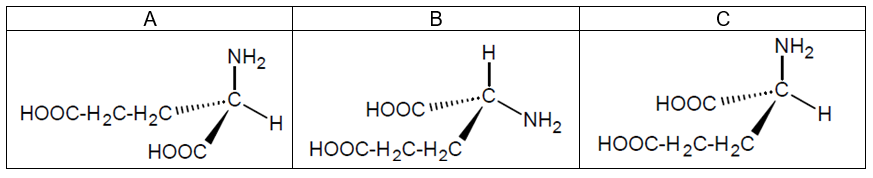
Indiquer si les molécules A et B, puis A et C, représentées ci-dessus, sont identiques, énantiomères ou diastéréoisomères.
1.3 Synthèse de Strecker de l’acide glutamique.
Une succession de réactions chimiques permet la synthèse d'un acide aminé à partir d'un aldéhyde. On fait réagir l’aldéhyde avec du chlorure d'ammonium (NH4Cl) en présence de cyanure de potassium (KCN) pour former un α-aminonitrile. Celui-ci est ensuite hydrolysé pour donner l'acide aminé désiré selon le schéma suivant :
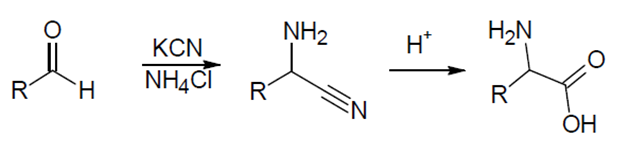
1.3.a Dans le cas de la synthèse de l’acide glutamique, donner la formule semi-développée du groupement R intervenant dans le schéma ci-dessus.
Une étape du mécanisme réactionnel d’une réaction de synthèse d’un acide aminé est reproduite ci-dessous :
1.3.b Recopier cette étape et représenter les flèches courbes qui permettent de rendre compte de cette étape.
1.3.c Associer à cette étape de la synthèse, en justifiant votre choix, une catégorie de réaction.
Le dipeptide GLU-SER
L’acide glutamique GLU et son dérivé le glutamate monosodique (MSG) couramment utilisé comme exhausteur de goût ne sont pas les seuls composés à contribuer à la saveur umami.
En 1973, dans le cadre de travaux sur le goût, le biochimiste japonais S. Arai a synthétisé quatre dipeptides « umami », dont le dipeptide GLU-SER.
On envisage de synthétiser en laboratoire ce dipeptide GLU-SER :
2.1 Écrire l’équation de la réaction conduisant au dipeptide GLU-SER à partir de deux acides aminés naturels, en utilisant des formules topologiques ou semi-développées.
2.2 Quelle est la fonction créée lors de la formation d’un dipeptide ?
2.3 Entourer sur les formules des molécules des deux réactifs apparaissant dans l’équation précédente les groupes caractéristiques à protéger.
2.4 Analyse de la composition d’un dipeptide par électrophorèse
L’analyse de la composition d’un dipeptide commence par une hydrolyse qui permet de réaliser l’opération inverse de la synthèse peptidique et d’obtenir un mélange d’acides aminés. Ces acides aminés peuvent ensuite être séparés et analysés par électrophorèse.
L'électrophorèse est une technique chromatographique qui s’effectue en présence d’un champ électrique.
L'échantillon « mélange » à analyser est déposé au centre d'un support solide conducteur (le plus simple étant un papier imbibé d'une solution ionique conductrice), soumis à un champ électrique entre ses deux extrémités. Les ions de charge positive migrent donc vers le pôle négatif, les ions de charge négative migrent vers le pôle positif et les espèces neutres ne migrent pas.
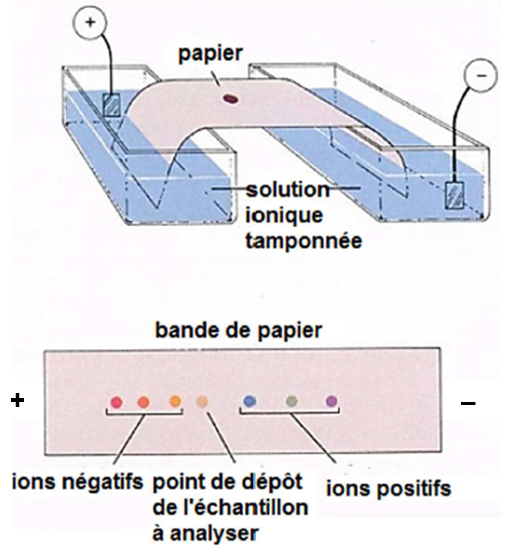
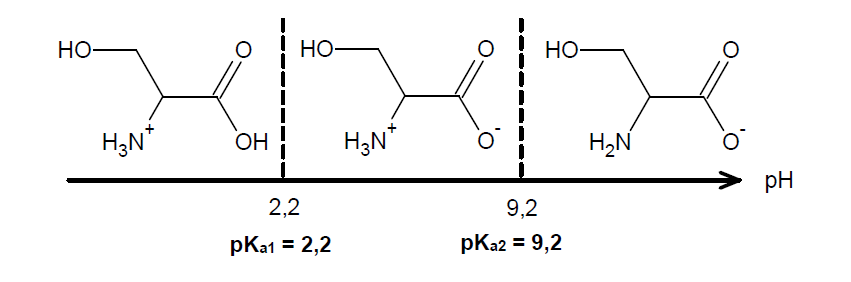
On désire séparer par électrophorèse un mélange aqueux tamponné de sérine SER et d'acide glutamique GLU.
À l’aide de vos connaissances et des trois documents suivants, déterminer la solution tampon à choisir pour séparer la sérine de l’acide glutamique par électrophorèse.
La démarche suivie et l’analyse des données seront correctement présentées. Toute démarche même partielle sera valorisée.

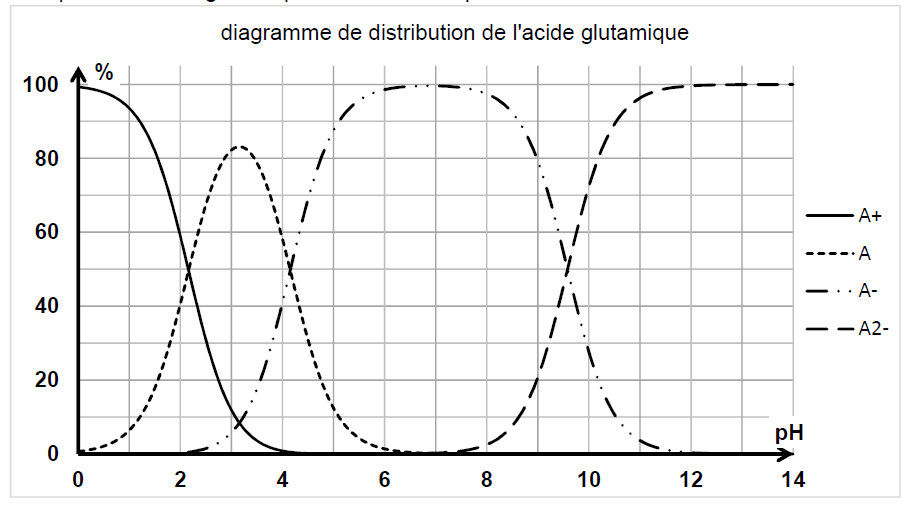
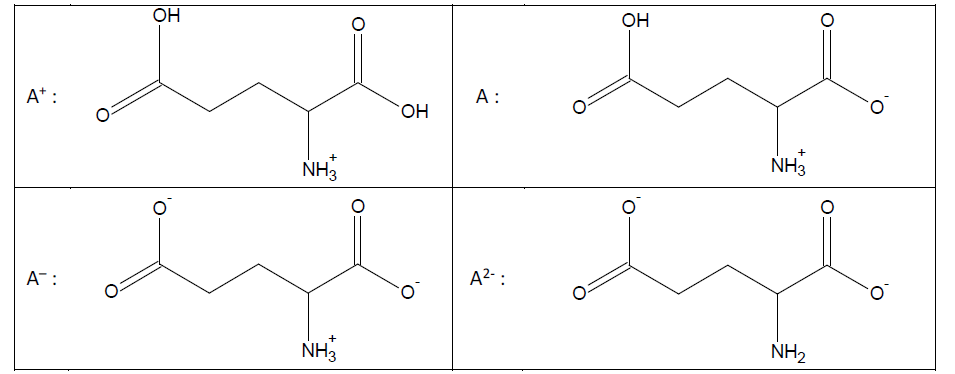
Représentations topologiques des espèces acido-basiques de l’acide glutamique2.5 Suite à la séparation de ces deux acides aminés, peut-on distinguer la sérine de l’acide glutamique en spectroscopie infrarouge ?























Si vous désirez une aide personnalisée, contactez dès maintenant l’un de nos professeurs !