Chapitres

Les mélanges
Mélange aqueux
Un mélange aqueux est un mélange qui contient de l'eau.
Exemples
Ce sont les mélanges que nous rencontrons le plus souvent dans notre quotidien. Les sodas sont tous des mélanges aqueux, les savons ou encore l'eau de la vaisselle. Chaque mélange qui contient une part d'eau est un mélange aqueux.
Mélange homogène
Un mélange homogène est un mélange dont on ne peut pas distinguer plusieurs constituant a l’œil nu.
La plupart du temps, c'est parce que les composants sont miscibles entre eux.
On dit de deux éléments qu'ils sont miscibles quand
Exemples
De nombreux mélanges homogènes peuplent notre quotidien : le jus de fruit, le lait, le savon, l'eau de javel ou encore le sang sont des mélanges qui contiennent énormément de composants mais nous ne sommes pas capables de les distinguer lorsque nous les voyons.
Mélange hétérogène
Un mélange hétérogène est un mélange dont on peut distinguer plusieurs constituant à l’œil nu. On entend par là tout mélange dans lequel plusieurs phases apparaissent.
Exemples
Tous les mélanges qui sont constitués de plusieurs composants sont hétérogènes. On y retrouve par exemple les jus de fruits à pulpe, la vinaigrette ou encore l'eau boueuse ou l'eau grasse.
Réussir une dilution

Description du principe
La dilution correspond à un procédé qui consiste en l'obtention d'une solution finale qui présentera une concentration inférieur à la concentration de la solution de départ. Il est alors possible de procéder à cela grâce à un ajout de solvant ou encore en prélevant une partie de la solution puis de compléter jusqu'à atteindre le volume souhaité avec du solvant. Il est alors possible de caractériser une dilution par son taux de dilution. Mais pour cela, il est nécessaire de présupposer que le corps dilué est soluble dans le solvant qui est utilisé.
Dilution par ajout de solvant
On note la concentration d'une solution C et il est possible de la calculer avec la formule suivante : 
Avec :
- C la concentration molaire. Cette unité s'exprime en mol.L-1 ;
- n la quantité de matière du soluté en solution. Cette unité s'exprime en mol ;
- Et V le volume de solvant. Cette unité s'exprime en L.
Ainsi, si on procède à une dilution par ajout de solvant, la solution initiale et la solution finale contiennent autant de quantité de soluté. Cela signifie alors que ninitiale = nfinale .
On a alors les relations suivantes qui se dégagent :
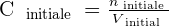

On peut déduire de ces relations le rapport suivant :
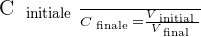
Taux de dilution
Il est possible d'exprimer le taux de dilution avec la relation suivante :
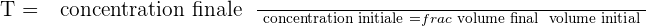
Il est important de savoir que le taux de dilution, noté T, est une grandeur sans unité et qui présente obligatoirement une valeur positive et inférieure à 1.
Quant au taux de dilutions successives, il correspond au produit des taux de dilution de chaque dilution.
Exemple
Si on procède à une dilution à 3 % puis à 5 %, on a T qui est égal à :

La dilution et les dosages colorimétriques
Un dosage colorimétrique correspond à un type de dosage qu'il est possible de réaliser lorsqu'une réaction chimique donne des produits colorées et si l'intensité de la coloration est proportionnelle à la concentration de l'élément chimique à doser. Cette réaction repose donc logiquement sur la loi de Beer-Lambert.
Notez qu'il est aussi possible de procéder à un dosage colorimétrique en utilisant des indicateurs colorés qui vont se colorer selon les variations de pH et donc indiquer le point d'équivalence de la réaction. Dans ce cas, on parle alors de titrage colorimétrique.
Pour procéder à un tel dosage, il est alors nécessaire de procéder à la conception d'une gamme étalon.
Extraction de l'espèce chimique

L'extraction d'une espèce chimique consiste à la séparer du mélange dans laquelle elle se trouve. Les différents procédés sont : l'enfleurage ( pétales de fleurs qu'on laisse tremper dans la graisse ), l'expression ( ou pressage ), la macération ( la plante reste dans un solvant de quelques heures à quelques semaines ), l'infusion ( de l'eau bouillante est versée sur la plante hachée ), la décoction ( on fait cuire la plante dans de l'eau bouillante ), l'extraction par solvant et l'hydrodistillation.
La décantation
Il s'agit d'une opération de séparation mécanique de plusieurs phases dont au moins une est liquide.
Elle consiste à laisser reposer un mélange hétérogène pour que les constituants les plus lourds, qui sont en suspension, se déposent au fond du récipient (des morceaux de pulpe de fruits, des gouttes de vinaigre dans une vinaigrette...). On peut alors récupérer le liquide au dessus du dépôt.
On utilise pour cela un ustensile de chimie : l'ampoule à décanter.
Une des plus grandes application de la décantation est celle que l'on retrouve dans les stations d'épurations. En effet, l'un des composants de ces dernières est le bassin de décantation. Dans ces cuves gigantesques, on fait stagner les boues qui descendent au fond tandis que les graisses remontent en surface. On peut alors extraire les composantes indésirables et retraiter l'eau claire.
La filtration
La filtration est un procédé de séparation qui permet de séparer des constituants liquides et solides d'un mélange hétérogène.
Elle consiste à faire passer à travers un filtre un mélange hétérogène contenant des particule en suspension. Ces particules sont alors retenues par le filtre. On recueille après filtration un mélange homogène appelé filtrat ainsi que dans le filtre des particules appelées résidus.
Il existe deux types de filtration : la filtration frontale et la filtration tangentielle.
Filtration frontale
La filtration frontale est la méthode de filtration la plus utilisée. C'est par exemple celle que l'on utilise dans une cafetière à filtre. On y insère le mélange à filtrer perpendiculairement au filtre. Il retient alors toutes les particules en laissant passer le liquide. L'inconvénient de ce système est que si trop de particules sont présentes dans le filtre il est possible que le filtre soit saturé et ne fonctionne plus.
Filtration tangentielle
Cette filtration permet de faire passer un fluide à la surface du filtre. Dans ce cas de figure, il s'agit de la pression du liquide qui lui permet de traverser le filtre. Les particules restent alors dans le flux, ce qui diminue le risque de colmatage du filtre. On utilise cette méthode pour filtrer des particules de petite taille, comprenant des tailles du micromètre jusqu'au nanomètre.
La centrifugation

Cette technique permet, tout comme la décantation, de séparer des composants des mélange homogène composé de partis solides et liquides. La centrifugation est par ailleurs plus rapide que la décantation.
Il s'agit d'une méthode utilisée très régulièrement en médecine analytique lors de la réalisation de prélèvement sanguins.
Son principe est de mettre ne rotation très rapide le mélange afin d’expulser les parties de masses différentes.
C'est le cas de l'essoreuse à salade.
Polarité des molécules
Une liaison entre deux atomes est polarisée si ces deux atomes sont différents. Une molécule est polaire si les barycentres de charges positives et négatives ne sont pas confondus ( la molécule H2O est polaire alors que CCL4 ne l'est pas ).
Deux molécules polaires ( alcool ROH, acide carboxylique RCOOH ) ou deux molécules non polaires ( alcane, alcène ) sont miscibles. Une molécule polaire et une molécule non polaire ne sont pas miscibles.
La distillation
La distillation est une méthode de séparation de mélange homogène composé d'éléments liquides et dont les températures d'ébullition sont différentes.
Elle permet également de séparer l'eau des autres constituants d'un mélange homogène.
Son fonctionnement est simple : le liquide est chauffé jusqu'à ébullition. Au contact d'une paroi refroidie que l'on appelle le réfrigérant, la vapeur d'eau formée se transforme en eau liquide. Les gouttelettes sont recueillies et on obtient un distillat qui est de l'eau. L'eau distillée ne contient que de l'eau, c'est donc une eau pure.
On utilise aussi la distillation pour la confection de boissons à base d'alcool comme les liqueurs ou encore pour fabriquer des parfums et récupérer des essences naturelles.
Dans le monde industriel, la distillation sert à préparer des dérivés du pétrole tels que de l'essence, du gasoil, du kérosène ou encore du mazout.
Il existe trois types de distillations :
La distillation discontinue
Une distillation discontinue est une distillation lors de laquelle on insère le mélange à séparer puis l'on chauffe à différentes températures pour séparer un à un les composants. Ce type de distillation peut subir des modifications du mélange à distiller ou des modifications de la température.
La distillation continue
La distillation continue est une distillation lors de laquelle on alimente en continue avec du mélange à séparer. On ne touche pas à la température de l’appareil cependant.
La distillation sous vide
Dans la distillation sous vide, on utilise une pompe à vide afin d'abaisser la pression ambiante pour réaliser la distillation. On utilise cette méthode lorsque les produits à distiller sont trop volatils à la pression ambiante. Cela permet donc de réduire leur point d'ébullition.
Le point d’ébullition correspond à un moment de pression et de température à partir duquel l’élément chimique bout, passant ainsi de l’état liquide à l’état gazeux
Extraction par hydrodistillation
Résumé
Une hydrodistillation ou entraînement à la vapeur d'eau est la distillation d'un mélange d'eau et d'un liquide organique.
Elle consiste à porter à ébullition le mélange, puis à condenser les vapeurs qui se dégagent afin de récupérer les arômes. La distillation obtenu contient deux phases :
- Une phase organique : l'huile essentielle.
- Une phase aqueuse : l'eau.
Pour récupérer l'huile essentielle, on recourt à une extraction liquide-liquide.
Description du principe
Dans un entraînement à la vapeur ou hydrodistillation, on fait bouillir un mélange d'eau et de produit à extraire, puis on liquéfie la vapeur dans un réfrigérant. La solution obtenue s'appelle le distillat.
Le but de cette technique est de récupérer les essences d'épices, de fleurs, de fruits ou des plantes.
Les étapes de l'hydrodistillation
Etape 1 : Extraction de l'huile essentielle d'orange
En se vaporisant, l'eau entraîne avec elles les huiles essentielles contenues dans le produit brut (clou de girofles, écorces d'oranges, lavande....). Les vapeurs arrivent dans le réfrigérant où la température est de l'ordre de 15°C.Elles se liquéfient dans l'éprouvette graduée.
Remarque : Le distillat obtenu obtenu en TP n'a qu'une seule phase puisqu'on extrait trop peu d'huile essentielle qui s'est solubilisée dans l'eau. On aurait extrait plus d'huile essentielle du zeste d'orange nous aurions alors obtenu deux phases puisque l'huile essentielle d'orange est faiblement soluble dans l'eau.
Etape 2 : Le relargage
Le relargage consiste à rendre des composés organiques (huile essentielle..) moins solubles dans l'eau en ajoutant du chlorure de sodium qui n'est autre que du sel. Après le relargage l'extraction sera donc plus facile.
Pour ce faire on place le distillat dans une ampoule à décanter et l'on rajoute de l'eau salée. On agite, dégaze et on laisse décanter. Cette étape permet ainsi de mieux séparer l'huile essentielle de la phase aqueuse puisque l'huile essentielle est moins soluble dans l'eau salée que dans l'eau.
On peut s'arrêter ici et récupérer l'huile essentielle à l'aide de l'ampoule à décanter.
Etape 3 : Extraction par solvant
On choisit le cyclohexane comme solvant extracteur puisqu'il est non miscible avec l'eau salée et que l'huile essentielle d'orange est très soluble dans le cyclohexane.
Le distillat étant déjà dans l'ampoule à décanter avec l'eau salée, nous rajoutons le cyclohexane. Nous agitons, dégazons et laissons décanter. Tout l'huile essentielle contenue dans la phase aqueuse passe dans la phase organique puisque l'huile essentielle est très soluble dans le cyclohexane. Il se forme également deux phases puisque le cyclohexane est non miscible avec l'eau salée. La densité du cyclohexane (=0,78) étant plus faible que celle de l'eau salée (=1,1) la phase sur-nageante est la phase organique contenant l'huile essentielle d'orange et le cyclohexane, quant à la phase sous-nageante il s'agit de la phase aqueuse contenant de l'eau salée.
L'utilisation de l'ampoule à décanter permet de séparer les deux phases en laissant s'écouler les liquides jusqu'à leur surface de séparation. Ainsi on introduit dans un premier temps la phase aqueuse sous-nageante dans un bécher et la phase organique sur-nageante dans un autre bécher. La phase aqueuse ne nous est pas utile, on s'en débarrasse.
Par contre, nous allons traiter la phase organique qui contient entre autre l'huile essentielle d'orange qui nous intéresse.
Etape 4 : Séchage
Maintenant nous allons "sécher" la phase organique. Bien que l'eau soit non miscible avec le cyclohexane il y a toujours des traces d'eau(très peu) dans le cyclohexane. Pour éliminer cette eau on utilise des grains de sulfate de magnésium anhydre (poudre) qui vont emprisonnés les molécules d'eau. Une fois la poudre introduite dans la phase organique il ne reste plus qu'à filtrer le sulfate de magnésium.
Le filtrat ainsi obtenue est la phase organique contenant le cyclohexane et l'huile essentielle d'orange. Quant à l'eau, elle est enfermé dans les grains de sulfate de magnésium qui ont été filtrés au niveau du papier filtre.
Etape 5 : Distillation
Le solvant extracteur employé à pour propriété d'avoir une température d'ébullition faible, ainsi en évaporant(distillation) le solvant organique volatil (cyclohexane) nous obtenons l'huile essentielle qui à été si difficile à extraire.
L'inconvénient reste la faible quantité d'huile essentielle récupérée au final, c'est en partie cela qui explique le prix élevé des parfums.
Extraction liquide - liquide
Principe
L'extraction liquide-liquide consiste à faire passer, par solubilisation, un composé d'un solvant dans un autre. Elle nécessite une phase aqueuse et une phase organique non miscibles et de densités différentes. En règle général, les espèces organiques se retrouvent, après extraction, dans la phase organique, et les espèces chimiques ioniques ou très polaires dans la phase aqueuse. Les espèces à la fois organiques et polaires se partagent entre les deux phases.
Mise en oeuvre expérimentale
L'espèce chimique à isoler est mélangée, ou partiellement dissoute, dans un solvant S1. On l'extrait avec un solvant extracteur S2 en plusieurs étapes.
- Le relargage : En ajoutant à S1, une espèce qui y est très soluble, on diminue la solubilité de l'espèce chimique à extraire.
- L'extraction : Elle est généralement réalisée dans une ampoule à décanter. S2 est ajouté par fraction ( pour augmenter le rendement ). Après chaque ajout de S2, on agite énergiquement pour permettre aux solutés de se répartir dans la phase où ils sont le plus solubles.
- Le lavage : En fin d'extraction, il est souvent utile d'éliminer des substances, autres que l'espèce à extraire, dissoutes dans le solvant S2. En général, pour éliminer une base, on introduit un acide et inversement.
Autre technique d'extraction : la macération
La macération consiste à faire tremper une substance dans un solvant froide ou ou chaud pour en extraire les espèces solubles dans le solvant utilisé.
La décantation permet alors de séparer des liquides non miscibles, alors que la filtration ( par gravité ou plus efficace, par aspiration ( sur Büchner )) permet de séparer un solide d'un liquide.
Identifier l'espèce chimique par chromatographie (adsorption et partage) sur couche mince, sur papier ou sur colonne
Principe
La chromatographie permet de séparer et d'identifier les espèces chimiques d'un mélange. Elle est basée sur leur différence d'affinité pour deux phases : la phase stationnaire, ou phase fixe et la phase mobile appelée éluant et constituée d'un mélange de solvants.
Chromatographie d'adsorption
La chromatographie sur couche mince ( CCM ) et la chromatographie sur colonne sont des chromatographies d'adsorption ; elles sont basées sur la différence d'adsorption sur la phase stationnaire ; des espèces à séparer entraînées par l'éluant. La phase stationnaire est solide (silice ou alumine).
Chromatographie de partage
La chromatographie sur papier est une chromatographie de partage basée sur la différence de solubilité des espèces à séparer. La phase stationnaire est formée par l'eau liée aux molécules de cellulose du papier.
Rapport frontal
Le rapport frontal Rf est une caractéristique d'une espèce chimique, dans un éluant donné et sur un support donné. Il est défini par :
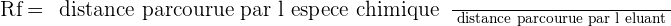
Après l'obtention de la molécule : décrire ses propriétés
Une fois que l'on est sûr que la molécule est la bonne, il peut être intéressant d'avoir recourt à une formule VSEPR, c'est à dire Valence Shell Electron Pair Repulsion, afin de décrire la structure de la molécule.
Labilité de la structure
En effet, en prenant l'exemple d'une structure en bipyramide trigonales, on considère la molécule présente une structure labile. Cela signifie que, par une pseudorotation de Berry, les deux atomes apicaux peuvent s'échanger avec deux atomes équatoriaux tandis que le troisième atome, qui reste donc inchangé, est appelé pivot de la pseudorotation.
On peut alors, via la description VSEPR d'une molécule, décrire sa labilité.
Rappels concernant la théorie VSEPR
La théorie VSEPR , signifiant en Anglais Valence Shell Electron Pair Repulsion, encore noté RPECV en Français, signifie « répulsion des paires électroniques de la couche de valence ». Cette théorie correspond à une méthode destinée à prédire la géométrie des molécules. Cela est possible en se basant sur la théorie de la répulsion des électrons de la couche de valence, également connue sous le nom de « théorie de Gillespie »
Prérequis et supposition
La méthode VSEPR est fondée sur un certain nombre de suppositions qui concernent principalement la nature des liaisons entre atomes :
- les atomes dans une molécule sont liés par des paires d'électrons ;
- deux atomes peuvent être liés par plus d'une paire d'électrons. On parle alors de liaisons multiples ;
- certains atomes peuvent aussi posséder des paires d'électrons qui ne sont pas impliqués dans une liaison. On parle de doublets non liants ;
- les électrons composant ces doublets liants ou non liants exercent les uns sur les autres des forces électriques répulsives. Les doublets sont donc disposés autour de chaque atome de façon à minimiser les valeurs de ces forces ;
- les doublets non liants occupent plus de place que les doublets liants ;
- les liaisons multiples prennent plus de place que les liaisons simples.
Notation
Dans la théorie VSEPR, il y a certains usages de notation à respecter :
- On note l'atome central de la molécule étudiée A.
- Les doublets non-liants, et donc les paires d'électrons appartenant à l'atome central A qui se sont pas impliqués dans les liaisons sont notés E et m leur nombre.
- Les doublets liants, et donc paires d'électrons qui sont impliqués dans des liaisons entre l'atome central A et un autre atome sont notés X. Le nombre de doublets liants sera noté n.
Les molécules simples, dont la géométrie est facilement définissable grâce à la méthode VSEPR sont donc notés suivant la notation vu ci-dessus et se présentent donc sous la forme : AXnEm






















Si vous désirez une aide personnalisée, contactez dès maintenant l’un de nos professeurs !