Chapitres

Un peu de cours
La masse
En physique, la masse correspond à une grandeur physique positive et intrinsèque d'un corps.
De façon plus précise, en physique newtonienne, la masse correspond à une grandeur extensive. Cela signifie alors que la masse d'un corps formé de parties correspond à la somme des masses de ces différentes parties qui le compose.
De plus, il est essentiel de noter que la masse est une grandeur conservative. De ce fait, elle reste constante dans le cas d'un système isolé qui n'échange donc pas de matière avec son environnement.
Pour une espèce donnée, la masse m, la quantité de matière n et la masse molaire M sont liés par : \[ n = \frac { m } { M } \] \[ m = n \times M \]
Les unités
L'ensemble des unités associées aux dimensions fondamentales constitue le système international d'unités. Il s'agit du système MksA (mètre, kilogramme, seconde, Ampère), mais le Kelvin, le mole et le candela font aussi partie de ce système. Ces unités sont appelées unités légales. Elles sont universelles et connues de par le monde entier.
Il est important de savoir que toutes les autres dimensions se déduisent de ces sept dimensions fondamentales par produit ou division de ces dimensions.
Dans certains sujets d'exercices, les grandeurs ne sont pas exprimées dans le système international mais avec des grandeurs usuelles. Il est facile de les comprendre et elles sont parfois utilisées dans la vie de tous les jours, mais il est essentiel de toujours effectuer les calculs avec les grandeurs exprimées dans l'unité internationale pour éviter les erreurs.
Le Système International d'unité, abrégé SI, devient le successeur du système métrique en 1960 à partir d'une résolution de la 11ème Conférence générale des poids et mesures. Ce système permet de rapporter toutes les unités de mesure à un petit nombre d'étalons fondamentaux, permettant aux scientifique de se consacrer à améliorer leur définition. Ce travail est l'une des missions des différents laboratoires nationaux de métrologie.
Les volumes
Afin de faciliter la mesure de grandes quantités de liquides, on est parfois amené à utiliser des mètres cubes, ce qui représente la quantité que contiendrait un cube d'un mètre de côté en eau. 1 mètre cube est équivalent à 1000 litres d'eau. On peut aussi retrouver le galon, unité de mesure américaine qui représente 3,785412 litres.
Le poids
Dans notre vie de tous les jours, nous utilisons de nombreuses unités pour quantifier tout ce qui nous entoure. Que ce soit les poids, les distances, l'argent, les mesures, tout a une unité. Chaque grandeur physique ou chimique est presque systématiquement associée à une unité indispensable pour lui donner un sens.

Pour mesurer des poids, l'unité la plus utilisée est le gramme. Mais selon les pays ou les utilisations, il en existe d'autres.
- Le carat : utilisé en bijouterie pour peser la quantité d'or, 1 gramme est égal à 5 carats ;
- L'once : de symbole oz, l'once était très utilisée au temps des romains et sous l'Ancien Régime en France. 1 once est égale à 28,35 grammes ;
- La livre : la livre est une unité de masse, multiple des onces. Elle n'est plus très utilisée aujourd'hui face au gramme. Cependant, il encore de trouver des mesures en livres en anglais. 1 livre est égale à 453,5924 grammes ;
- La stone : unité de mesure encore utilisé dans les pays tels que le Royaume-Uni et l’Irlande, la stone vaut 14 livres. 1 stone est donc égale à 6350,293 grammes.
- La tonne : une tonne est égale à 1000 kilogrammes. On l'utilise par exemple pour peser les camions et leurs cargaisons.
Exercices
Exercice 1 : Le thermomètre de Galilée
Galileo Galilei, dit Galilée (1564-1642) était un mathématicien, physicien et astronome italien. Célèbre pour ses travaux sur la chute des corps et pour ses observations célestes, il travailla aussi sur la mesure de la température. C 'est à partir de l'une de ses idées qu'a été confectionné le thermomètre dit de Galilée.
Cet exercice vise à comprendre le fonctionnement de ce thermomètre.
Cet objet décoratif est constitué d'une colonne remplie d'un liquide incolore et de plusieurs
boules en verre soufflé, lestées par une petite masse métallique.
Le liquide contenu dans la colonne a une masse volumique (T) qui décroît fortement lorsque
la température augmente. Les boules ont chacune le même volume mais possèdent des masses différentes. Un petit médaillon indiquant une température est accroché sous chacune d'elles. Chaque boule possède une masse ajustée de manière précise. Pour un modèle commercial courant, on trouve onze boules indiquant des températures comprises entre 17 °C et 27 °C.
Dans cet appareil, on peut observer que certaines boules sont situées en bas de la colonne et que d'autres flottent en haut. La température de la colonne est indiquée par la boule qui se trouve en équilibre dans le liquide c'est-à-dire par la plus basse des boules situées en haut de la colonne.
1. Principe de fonctionnement

On décide de construire un thermomètre. On utilise une éprouvette remplie d'une huile de masse volumique (T) dans laquelle on place des boules de même volume Vb mais de masses volumiques différentes. On constate que certaines boules flottent et d'autres coulent.
On s'intéresse dans cette partie à la boule 1 de volume Vb et de masse volumique r. On peut supposer que la masse volumique et le volume de cette boule sont quasiment indépendants de la température contrairement à ceux du liquide dans lequel elle est immergée. La boule 1 est immobile, en équilibre dans l'huile.
1.1 Faire un inventaire des forces s'exerçant sur la boule 1. Les représenter sur un schéma sans souci d'échelle.
1.2 Exprimer ces différentes forces en fonction de r, (T), Vb et de g, l'intensité du champ de pesanteur.
1.3. Établir l'expression littérale de la masse volumique r que doit avoir la boule 1 pour rester immobile.
1.4. Expliquer pourquoi, hormis la boule 1, les boules restent les unes en haut de la colonne, les autres en bas.
1.5. Lorsque la température du liquide s'élève, la boule 1 se met en mouvement. Justifier dans quel sens.
2. Étude du mouvement d'une boule.
On utilise le même liquide que précédemment et on y place une seule boule de masse m de centre d'inertie G. Le liquide contenu dans l'éprouvette est à 18 °C, on constate qu'à cette température, la boule flotte. On chauffe alors légèrement le liquide jusqu'à 20 °C, on plonge à nouveau la boule à l'intérieur et on constate qu'elle descend le long de l'éprouvette. On prend pour origine des dates (t = 0 s) l'instant où on a plongé la boule dans le liquide. On modélise la valeur f de la force de frottement fluide du liquide sur la boule par f= k.v, avec v, la vitesse du centre d'inertie de la boule et k le coefficient de frottement. On définit un axe Oz dirigé vers le bas, le point O coïncide avec le centre d'inertie de la boule à l'instant de date t = 0 s.
2.1. Représenter, à l'aide d'un schéma, sans souci d'échelle, mais de façon cohérente, les forces s'exerçant sur la boule en mouvement.
2.2. En utilisant la deuxième loi de Newton, montrer que la vitesse v(t) du centre d'inertie de la boule obéit à une équation différentielle de la forme :
\[ \frac {dv} {dt} = A - B \cdot v \]
Donner les expressions littérales de A et de B en fonction de m, g, k, (T) et Vb.
2.3 Établir l'expression littérale de la vitesse limite atteinte par la boule.
On donne A = 9,5 x 10 –3s -2 et B = 7,3 x 10 –1 s -1. Calculer sa valeur.
2.4 On se propose de résoudre l'équation différentielle \[ \frac {dv} {dt} = A - B \cdot v \] et de construire la courbe v = f(t) en utilisant la méthode d'Euler. Cette méthode itérative permet de calculer, pas à pas, de façon approchée, les valeurs de la vitesse instantanée de la boule à différentes dates.
On utilise la relation suivante : v(tn) = v(tn-1) + Δv(tn-1) avec Δv(tn-1) = a(tn-1) . Δt tn = tn-1 + Δt où Δt est le pas d'itération du calcul.
En utilisant l'équation différentielle et la relation d'Euler, recopier sur la copie le tableau suivant et le compléter :
| Dates t en s | Vitesse v(tn) en m.s-1 | Δv(tn) en m.s-1 |
|---|---|---|
| t0= 0 | 0 | |
| t1= 0,10 | 8,8 x 10-4 | |
| t2= 0,20 |
La courbe v = f(t) que l'on obtient par la méthode d'Euler lorsqu'on utilise un tableur est reproduite ci-dessous :
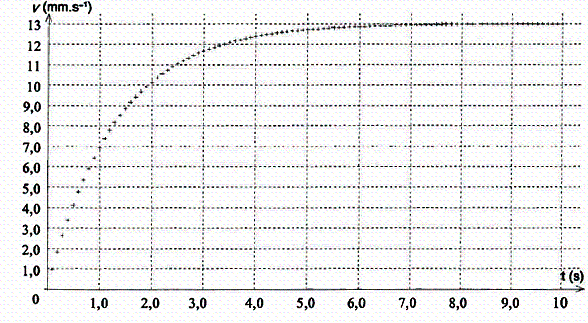
2.5 Indiquer les différents régimes observés sur la courbe v = f(t).
2.6 Déterminer graphiquement, en prenant soin d'expliquer votre méthode, le temps caractéristique t.
2.7 Justifier le choix de la valeur du pas utilisé Δt = 0,10 s.
Données :
Rayon de la boule : R = 1,50 x 10 –2 m
Volume de la boule : \[V _ { b } = \frac {4} {3} \cdot \pi \cdot R ^ {3}\]
Masse de la boule : m = 12,0 x 10–3 kg
Masse volumique du liquide à 20°C : 848 kg.m-3
Coefficient de frottement : k = 8,8 x 10–3 kg.s-1
Intensité de la pesanteur : g = 9,80 m.s -2
Exercice 2 : Le vin et le vinaigre
On peut produire du vinaigre à partir de différentes boissons alcoolisées comme le vin ou le cidre. En présence de dioxygène, l’éthanol C2H6O, contenu dans un vin ou un cidre est transformé en acide éthanoïque C2H4O2 (également appelé acide acétique) et en eau. Cette réaction, appelée fermentation acétique, est catalysée par une enzyme présente dans la bactérie Mycoderma Aceti.
L’objectif de cet exercice est l’étude de la transformation de l’éthanol en acide acétique et la détermination du degré alcoolique du vin qui a permis la fabrication d’un vinaigre. On considère que cette transformation est totale, et qu’elle s’effectue à volume constant.

Données :
- Masses molaires atomiques : M(H) = 1,0 g.mol-1 ; M(C) = 12,0 g.mol-1 ; M(O) = 16,0 g.mol-1 ;
- Masse volumique de l’éthanol à température ambiante : ρ(éthanol) = 0,79 g.mL-1 ;
- Le degré d’acidité d’un vinaigre (en °) correspond à la masse d’acide éthanoïque pur (en g) contenue dans 100 g de vinaigre soit environ 100 mL de vinaigre. Par exemple, un vinaigre à 10° contient 10 g d’acide éthanoïque pour 100 g de vinaigre ;
- Le degré alcoolique d’un vin (en °) correspond au volume d’éthanol pur (en mL) contenu dans 100 mL de vin ;
- Extrait d’une table de nombres d’onde dans le domaine des infrarouges :
| Liaison | Famille chimique | Nombre d’onde (en cm-1) |
|---|---|---|
| C- H | Alcane Alcène | 2480 – 3000 > 3000 |
| O - H | Alcool Acide carboxylique | 3200 – 3400 2500 – 3300 |
| C = O | Acide carboxylique Ester Aldéhyde ou cétone Amide | 1700 – 1725 1700 – 1750 1650 – 1740 1650 – 1695 |
1. De l’éthanol à l’acide éthanoïque
1.1. Représenter les formules topologiques de l’éthanol et de l’acide éthanoïque.
1.2. Entourer les groupes caractéristiques sur les formules topologiques précédentes. Nommer les familles chimiques associées à ces groupes.
1.3. Écrire l’équation de la réaction de fermentation acétique.
1.4. Indiquer si le spectre infrarouge ci-après est celui de l’éthanol ou celui de l’acide éthanoïque. Justifier.
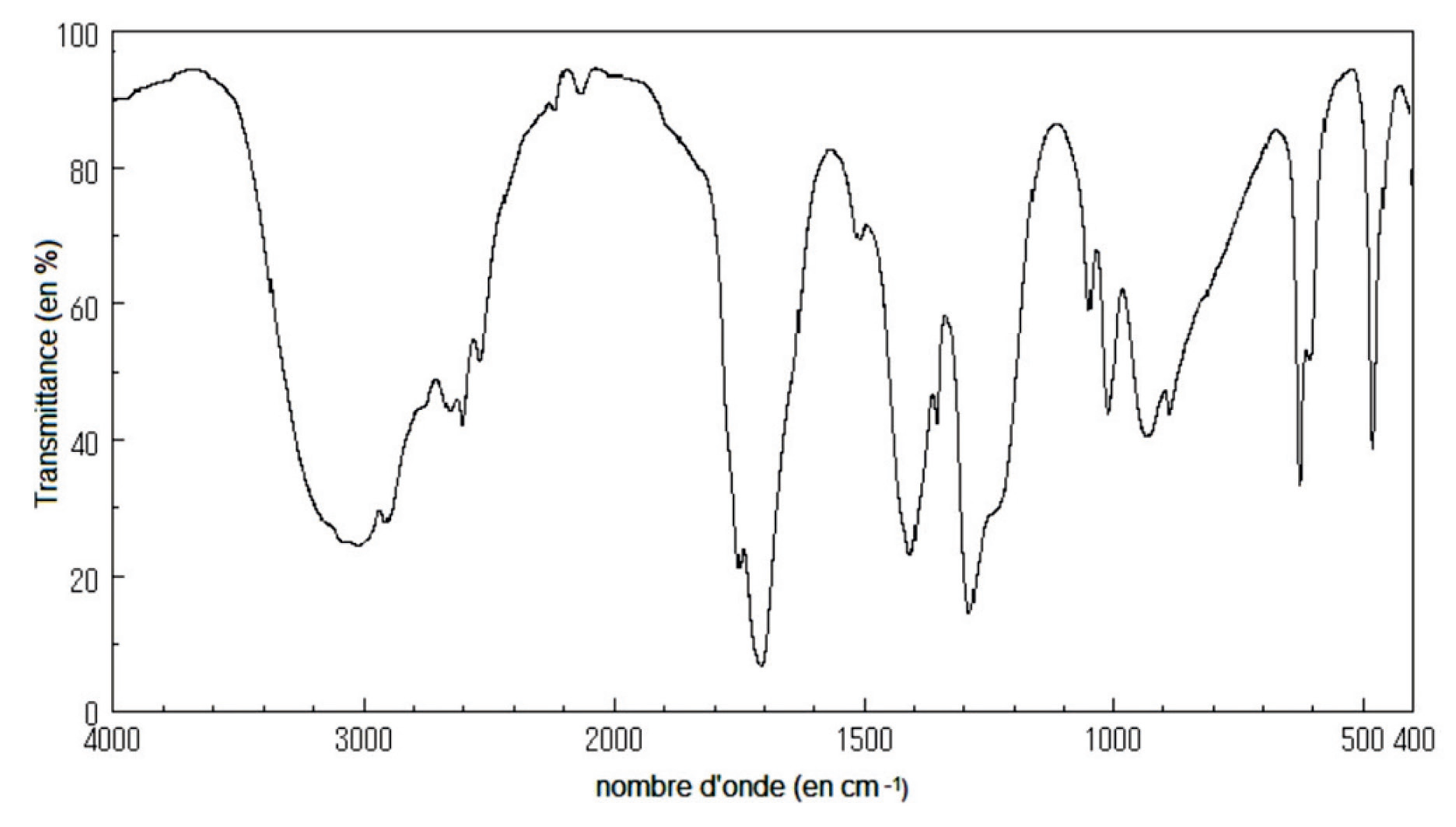
1.5. Le pH d’une solution aqueuse d’acide éthanoïque de concentration molaire 2,5 mmol.L-1 est égal à 3,7. L’acide éthanoïque est-il un acide fort ? Justifier.

2. Degré alcoolique du vin blanc ayant servi à fabriquer un vinaigre
2.1. Montrer que la fermentation acétique de 1,0 g d’éthanol permet d’obtenir 1,3 g d’acide éthanoïque.
2.2. Déterminer le degré alcoolique du vin qui a permis d’obtenir le vinaigre de vin blanc dont l’étiquette est reproduite en introduction.
Le candidat est invité à prendre des initiatives et à présenter la démarche suivie, même si elle n’a pas abouti. La démarche est évaluée et nécessite d’être correctement présentée.






















Si vous désirez une aide personnalisée, contactez dès maintenant l’un de nos professeurs !