Chapitres
- 01. Formules de chimie
- 02. Cinétique chimique
- 03. Équilibre chimique
- 04. Acide et base
- 05. Piles
- 06. Électrolyse
- 07. Fonctions organiques oxygénées
- 08. Estérification, hydrolyse, saponification
- 09. Estérification et hydrolyse de l'ester
- 10. Influence de certains facteurs sur les réactions d'estérification et d'hydrolyse des esters
- 11. Acide et base selon Brönsted

Formules de chimie
Concentration
C = n / V
n : nombre de moles en solution dans un volume V ( mol.L-1 )
Masse volumique
ρ = m / V.
m : masse d'un volume V d'une substance ( kg.m-3 )

Quantité de matière
n = m / M
n : nombre de moles ( en mol ) d'atomes, de molécules, d'ions ( ou d'autres entités élémentaires ) dans une masse m ( en g ) de ces entités ; m ( en g ) de ces entités ; M : masse molaire ( en g.mol-1 ) de l'atome, de la molécule, de l'ion... )
Loi des gaz parfaits
p.V = n.R.T.
n : quantité de matière ( mol ) ; V : volume occupé par le gaz ( m3 ) ; P : pression du gaz ( Pa ) ; R = 8,314 J.mol-1.K-1 ; T : température ( K )
Volume molaire d'un gaz parfait
p.Vm = R.T.
Le volume molaire d'un gaz est le volume occupé par une mole de gaz sous une pression p, à une température T.
Vm = 22,4 L.mol-1 à 0° C sous 1 Atm = 1013 hPa ; Vm = 22,79 L.mol-1 à 0° C sous 1 bar
Rendement d'une réaction
η = mexp / mthéo.
Le rendement d'une réaction est le rapport entre la masse obtenue expérimentalement et la masse attendue théoriquement.
Quantité d'électricité
Q
Q s'exprime en coulomb ( C ). Un faraday ( F ) correspond à la charge d'une mole d'électrons : 1F = 96 500 C.
Vous cherchez un professeur de physique chimie ?
Cinétique chimique
Facteurs cinétiques
En cours physique chimie ts, la vitesse d'une réaction est d'autant plus grande que les concentrations des réactifs sont plus importantes ; la température est élevée.
Vitesse volumique à l'instant T1
v(t1) = 1 / V . ( dx / dt ).
V : volume de la solution ( en L ), t ( en s ), v ( en mol.L-1.s-1 )
x(t) avancement de la réaction en fonction du temps
La vitesse volumique est proportionnelle à la pente de la tangente ( dx / dt ) à la courbe x = f(t) à l'instant t1
Temps de demi-réaction T1/2
Le temps de demi-réaction est la durée nécessaire pour que l'avancement parvienne à la moitié de sa valeur finale.
Équilibre chimique
Avancement d'une réaction
Une transformation chimique n'est pas toujours totale : si aucun des réactif n'a totalement disparu ; si l'avancement final xf est inférieur à l'avancement maximal xmax ; le taux d'avancement ( τ = xf / xmax ) est inférieur à 1.
Quotient de réaction
Qr = ( [ E]2 / ( [ A ]2 . [ B ]2 ) )
[ X ] : concentration en mol.L-1
Qr n'a pas d'unité
Seules les espèces dissoutes figurent dans l'expression. Qr dépend des conditions initiales et de l'avancement de la réaction. Constante d'équilibre Qr,e = K.
K ne dépend que de la température.
Si K >> 1, la réaction directe ( → ) est très favorisée.
Prêt pour un cours physique chimie 1ere s ?
Critère d'évolution
Qr,i < K : évolution spontanée dans le sens direct ( → )
Qr,i > K : évolution spontanée dans le sens inverse ( ← )
Qr,i = K : état d'équilibre.
Comment progresser en cours physique chimie college ?
Acide et base
Équilibres acido-basiques dans l'eau
Les deux équilibres sont simultanées.
HA + H2O = A- + H30+.
2H2O = H3O+ + OH-. (autoprotolyse de l'eau )
pH = -log[ H3O+ ] = pKa – log( [ A- ] / [ HA ] ).
Ka = ( [ A- ] . [ H3O+ ] ) / [ HA ]
Ke = [ H3O+ ] . [ OH- ] = 10-14.
CH3CO2H/CH3CO2- : pKa = 4,7 ; NH4+ / NH3 : pKa = 9,2.
En solution aqueuse, un acide est d'autant plus dissocié que son pKa est faible
Dosages acido-basiques
Acide 1 + Base 2 = Base 1 + Acide 2
K = ( [ Base 1 ] . [ Acide 2 ] ) / ( [ Acide 1 ] . ( [ Base 2 ] )
K = Ka1 / Ka2. Si K >> 1, le taux d'avancement final est proche de 1.
À l'équivalence : ca . Va = cb . Vb.
Utilisation d'indicateurs colorés
1 : Acide fort-base forte : bleu de bromothymol.
2 : Acide faible-base forte : phénolphtaléine.
3 : Acide fort-base faible : hélianthine.
Piles
Constitution
Une pile est formée de deux demi-piles reliées par un pont salin ou séparées par une paroi poreuse.
Schéma conventionnel
(-) Zn(s) l Zn2+(aq) l l Cu2+(aq) l Cu(s) (+)
Équations aux électrodes
> Pôle (+) : cathode → réduction. ( mnémotechnique : deux consonnes )
> Cu2+(aq) + 2e- = Cu(s).
> Pôle (-) : anode → oxydation. ( mnémotechnique : deux voyelles )
> Zn(s) = Zn2+(aq) + 2e-.
Pour un avancement x = 1 mol, il y a deux moles d'électrons échangées. La réaction est totale dans le sens direct.
Quantité de matière et intensité du courant
Q = I.t.
( I en ampère ( A ) ; t en seconde ( s ) ; Q en coulomb ( C ) )
1 Faraday ( F ) = 96 500 C : charge d'une mole d'électrons.
Avancement de la réaction : x = Q / 2F = ( I.t ) / 2F.
Où trouver un professeur de physique pour progresser ?
Électrolyse
L'électrolyse est une transformation chimique forcée. Le générateur impose le sens du courant.
| Électrode | Réaction | |
|---|---|---|
| Anode | Reliée à la borne (+) du générateur | Oxydation : 2Cl- = Cl2 + 2e- |
| Cathode | Reliée à la borne (-) du générateur | Réduction : Cu2+ + 2e- = Cu |
| Réaction bilan | 2Cl- + Cu2+ = Cl2 + Cu 2F échangés pour Δx = 1 mol | |
Quantité d'électricité nécessaire
Q = I.Δt = F.z.x.
( F = 96 500 C ; x : avancement de la réaction bilan ; z : nombre d'électrons échangés pour Δx = 1 mol ; Δt : durée de l'électrolyse ( en s ) ; I : intensité du courant ( en A ).
Fonctions organiques oxygénées
| Alcool | R-O-H | Se transforme en ester |
|---|---|---|
| Acide carboxylique | Acide Donne des esters et des anhydrides | |
| Ester | S'hydrolyse en milieu acide Se saponifie en milieu basique | |
| Anhydride d'acide | Forme des esters avec les alcools S'hydrolyse dans l'eau en donnant un acide carboxylique | |
| Savon | Base Forme des micelles si la chaîne carbonée R est longue |
Estérification, hydrolyse, saponification
Estérification et hydrolyse de l'ester
Equation de la réaction
L'estérification est la réaction qui permet d'obtenir un ester. On peut, pour cela faire réagir un acide carboxylique R—COOH avec un alcool R'—OH. Cette réaction conduit à un ester R—COO—R' et de l'eau suivant l'équation:
R—COOH + R'—OH = R—COO—R' + H2O
La réaction en sens inverse entre l'ester et l'eau qui conduit à un alcool et à un acide carboxylique est appelée hydrolyse de l'ester et se produit simultanément.
Propriétés des réactions d'estérification et d'hydrolyse de l'ester
Ces deux réactions sont:
- lentes,
- limitées par leur réaction inverse (l'estérification est limitée par l'hydrolyse de l'ester formé),
- athermiques. Elles ne nécessitent pas d'apport d'énergie thermique (chaleur) pour se produire et ne dégagent pas d'énergie thermique. Ce qui ne signifie pas qu'un apport d'énergie thermique soit sans effet sur ces transformations comme nous le verrons plus loin.
Estérification
R-CO2H + R' = R-CO2-R' + H2O
( acide carboxylique + alcool = ester + eau )
Hydrolyse
R-CO2-R' + H2O = R-CO2H + R'-OH
Saponification
R-CO2-R' + OH- = R-CO2- + R'-OH
( ester + ion hydroxyde = ion carboxylate + alcool )
| Cinétique | Equilibre | Commentaires | |
|---|---|---|---|
| Esthérification | Réaction lente catalysée par H+ | Réaction limitée | Équilibre modifié par : Un excès de l'un des réactifs En distillant un des produits |
| Hydrolyse | Réaction lente catalysée par H+ | Réaction limitée | |
| Saponification | OH- n'est pas un catalyseur | Réaction totale | Préparation des savons à partir d'esters dont les chaînes carbonées sont longues et non ramifiées. |

Catalyseur
Un catalyseur est une substance qui augmente la vitesse de réaction sans apparaître dans l'équation de la réaction.
Influence de certains facteurs sur les réactions d'estérification et d'hydrolyse des esters
Introduction
Ces facteurs peuvent modifier la vitesse de réaction ou la composition du milieu réactionnel à l'équilibre.
Influence de la température
Sur le taux d'avancement final (composition à l'équilibre)
Une modification de la température du milieu réactionnel est sans influence sur le taux d'avancement final. Cela est du au fait que ces réactions sont athermiques. Cela signifie aussi que la constante d'équilibre est indépendante de la température, contrairement à ce qui est observé pour la grande majorité des autres transformations.
Sur la cinétique des transformations
Qu'il s'agisse de l'estérification ou de l'hydrolyse d'un ester, une élévation de la température du milieu réactionnel augmente la vitesse de réaction. Cela signifie que l'équilibre est atteint plus rapidement (sans que la composition à l'équilibre soit modifiée).
Influence d'un catalyseur
Définition d'un catalyseur
Un catalyseur est une espèce chimique, introduite dans le milieu réactionnel, qui a pour effet d'augmenter la vitesse de réaction sans figurer dans l'équation de la réaction (voir dernier chapitre: la catalyse).

Sur une voiture, un catalyseur ou pot catalytique est une pièce du pot d'échappement qui est en charge d'augmenter la vitesse de réaction des gaz d'échappement pour modifier la teneur en gaz toxiques éjectés par le pot.
Catalyse des réactions d'estérification et d'hydrolyse de l'ester
Les ions oxonium (H3O+ ou plus simplement H+) catalysent aussi bien la réaction d'estérification que la réaction inverse. Ils sont fréquemment introduits dans le milieu réactionnel par l'acide sulfurique ou l'acide paratoluènesulfonique.
Ce catalyseur permet d'atteindre plus rapidement l'état d'équilibre sans changer la composition du milieu réactionnel à l'équilibre.
Acide et base selon Brönsted
Un acide est une espèce chimique capable de céder un proton H+.
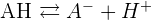
Une base est une espèce chimique capable de capter un proton H+.
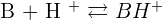
On obtient donc une réaction acido-basique :
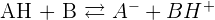
Dans cet exemple, on peut alors parler de :
- Couple AH/A-
- Couple BH+/B
Il y a un transfert d'un proton H+ entre l'acide d'un couple et la base d'un autre couple.
A chaque acide est associé une base qui est dite base conjuguée (réciproquement). Les deux forment un couple Acide/Base.
Le pH
Le pH, ou encore potentiel hydrogène, correspond à une mesure de l'activité chimique de ce qu'on appelle les hydrons dans une solution. Mais vous les connaissez plus certainement sous le nom de protons ou encore ions hydrogènes. De façon plus particulière, ces protons, dans une solution aqueuse, se présentent sous la forme de l'ion hydronium qui représente le plus simple des ions oxonium.
Le pH est, le plus souvent, utilisé afin de mesurer l'acidité ou encore la basicité de la solution. On peut alors la déterminer avec l'échelle suivante dans le cas d'un milieu aqueux à 25°C :
- Une solution de pH égal à 7 est considérée comme étant neutre ;
- Une solution de pH inférieur à 7 est considérée comme étant acide. De ce fait, plus son pH diminue, plus elle est acide ;
- Une solution de pH supérieur à 7 est considérée comme étant basique. De ce fait, plus son pH augmente, plus elle est basique.
Mais la définition que nous connaissons aujourd'hui du pH, définition de Sorensen, n'a été officiellement reconnue qu'à partir du milieu du XXe siècle par l'UICPA :
L’UICPA, l’Union Internationale de Chimie Pure et Appliquée est une organisation non gouvernementale ayant son siège à Zurich, en Suisse. Créée en 1919, elle s’intéresse au progrès de la chimie, de la chimie physique et de la biochimie. Ses membres sont les différentes sociétés nationales de chimie et elle est membre du Conseil International pour la Science.
L’UICPA est une autorité reconnue dans le développement des règles à adopter pour la nomenclature, les symboles et autres terminologies des éléments chimiques et leurs dérivés via son Comité Interdivisionnel de la Nomenclature et des Symboles. Ce comité fixe la nomenclature de l’UICPA.
Cette définition est donc celle que nous retrouvons dans les manuels scolaires et s'énonce ainsi :

Avec aH, également noté aH+ ou [H+], qui correspond à l'activité des ions hydrogène H+. aH correspond donc à une grandeur sans dimension tout comme le pH.
Néanmoins, cette définition ne nous permet pas d'obtenir des mesures directes du pH ni même des calculs. En effet, le pH dépend uniquement de l'activité des ions hydrogènes. De ce fait, le pH dépend de plusieurs autres facteurs découlant de cette activité. On peut par exemple parler de l'influence du solvant ou encore de la température.
Il reste cependant possible d'obtenir des valeurs approchées du pH en utilisant ce calcul. Pour cela, il est nécessaire de faire appel à des définitions de l'activité.
Cette définition formelle ne permet pas des mesures directes de pH, ni même des calculs. Le fait que le pH dépende de l’activité des ions hydrogène induit que le pH dépend de plusieurs autres facteurs, tels que l’influence du solvant. Toutefois, il est possible d’obtenir des valeurs approchées de pH par le calcul, à l’aide de définitions plus ou moins exactes de l’activité.
Remarque
Le p de pH représente la fonction "- log" donc ici - log (H). Donc si on parle de pOH ou de pKa, cela signifie que l'on parle de - log (OH) et de - log (Ka).
Une nouvelle définition du pH

Aujourd'hui, une autre définition du pH a été donné par l'UICPA. Cette définition, déterminée grâce à une méthode électrochimique expérimentale, consiste à utiliser la relation de Nernst dans une cellule électrochimique définie comme qui suit :
Électrode de référence | Solution de KCl concentré | Solution X | H2 | Pt (électrode à hydrogène)
Ainsi, via des mesures de ce qu'on appelle force électromotrice, également notée fem ou f.e.m., de la cellule avec une solution de référence notée S, on peut obtenir la relation suivante : 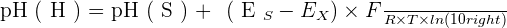
Avec :
- pH(X) représentant le pH de la solution inconnue ;
- pH(S) représentant le pH tabulé de la solution de référence S ;
- EX représentant la f.e.m. de la cellule avec la solution inconnue X ;
- ES représentant la f.e.m. de la cellule avec la solution de référence S à la place de la solution X ;
- F = 96 485 C mol−1 représentant la constante de Faraday ;
- R = 8,314 472 J mol−1 représentant la constante universelle des gaz parfaits ;
- Et T représentant la température absolue, en kelvins.La mesure de pH
La mesure du pH peut se faire à l'aide d'outils comme :
- Le papier pH qui indique la valeur du pH à une unité près ;
- Ou le pHmètre qui indique, quant à lui, une valeur du pH à 0.1 unité près.
A noter que le pH est plus généralement mesuré grâce au pH-mètre, celui-ci reposant sur l'électrochimie et restant plus précis que le papier pH qui n'est qu'un indicateur. Le pH-mètre est un appareil composé d'une électrode combinée spéciale, également appelée électrode de verre, ou encore de deux électrodes séparées. De façon générale, l'électrode de référence utilisée dans les pH-mètre correspond à une électrode au calomel saturée, également notée ECS.
Mais le pH peut également être trouvé par calcul :
En effet, d'après la loi de Nernst, 
Avec :
- X représentant la solution dont on cherche à déterminer le pH ;
- S représentant la solution de référence ;
- R représentant la constante de gaz parfaits ;
- T représentant la température ;
- F représentant la constante de Faraday.
Il peut être intéressant de noter que, à une température de 298 K, on obtient :
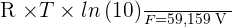
Ce qu'il faut savoir sur le Ka et le pKa
Le Ka correspond à la constante d'acidité, encore appelée constante de dissociation acide. Elle permet la mesure quantitative de la force d'un acide en solution. En effet, cette constante permet également de connaître l'équilibre d'une espèce acide dans le cadre d'une réaction acido-basique. De cette façon, plus le Ka est élevé, plus la dissociation des molécules en solution est grande. On peut alors dire que la force d'un acide est proportionnelle au Ka.
En chimie, une constante d'acidité ou constante de dissociation acide, Ka, est une mesure quantitative de la force d'un acide en solution. C'est la constante d'équilibre de la réaction de dissociation d'une espèce acide dans le cadre des réactions acido-basiques. Plus cette constante Ka est élevée, plus la dissociation des molécules en solution est grande, et donc plus fort est l'acide.
Soit :
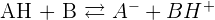
Avec :
- Couple AH/A-
- Couple BH+/B
On considère alors que AH correspond à un acide générique qui va, en se dissociant, donner l'acide A- qui est sa base conjuguée, ainsi qu'un ion hydrogène H+ que l'on appelle également proton. Si la réaction se déroule dans un milieu aqueux, ce proton devient un proton solvaté H3O+.
On considère alors que les espèces chimiques AH, A- et H+ sont en équilibre si leur concentration ne varie pas en fonction du temps. On peut alors écrire la constante d'équilibre sous la forme de quotient de concentrations des différentes espèces à l'équilibre (en mol/L), notées [AH], [A-] et [H+]. On obtient donc :

Pour obtenir le pKa, tout comme le p de pH, le p de pKa représente la fonction "- log" donc ici - log (Ka). Donc si on parle de pOH ou de pKa, cela signifie que l'on parle de - log (OH) et de - log (Ka). On a donc :
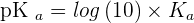























Si vous désirez une aide personnalisée, contactez dès maintenant l’un de nos professeurs !
Merci
La chimie c’est ma passion.
COMENT AVOIR UN PROF DE SOUTIEN EN LIGNE
Bonjour IDS ! Rendez-vous sur la plateforme de Superprof, sélectionnez la rubrique « Découvrir nos Superprofs » en indiquant la matière désirée. Vous trouverez de nombreux professeurs près de chez vous. 🙂
S’il vous plaît donner moi la possibilité de gagner dans une documents tout les formules chimie s’il vous plaît…
Bonjour, il nous ferait plaisir de vous aider, n’hésitez pas à contacter nos professeurs sur la plateforme de Superprof 🙂
Merci bien , très formateur
Je t’aime puis-je avoir ton numéro téléphone