Chapitres

Caractérisation de l’américium
Aspect et description de l'américium
L’américium (symbole Am) est un élément chimique classé dans le tableau périodique (aussi appelé tableau de Mendeleïev). C’est un élément transuranien appartenant à la famille des actinides. Les transuraniens correspondent à une série d’éléments chimiques, des éléments dits lourds, découverts à partir des années 1940. L’américium est un élément artificiel qui se forme principalement lors de l'irradiation du plutonium 239 par les neutrons, dans les réacteurs nucléaires. C’est donc l’Homme qui est à l’origine de sa création et de sa production.
C’est un élément artificiel, c’est-à-dire synthétique et créé par l’Homme, que l’on ne retrouve donc pas dans la nature.
Américium est un nom faisant référence au continent américain. D’autres éléments chimiques ont un nom construit de façon semblable, tel que l’europium par exemple, qui fait référence à l’Europe. 
Constitution électronique
Le numéro atomique de l’américium étant 95, cela signifie que cet élément chimique dispose de 95 protons, et donc d’autant d’électrons afin d’être électriquement neutre. Il présente également 148 neutrons. Ces 95 électrons sont répartis sur les différentes couches électroniques, de la plus proche du noyau à la plus éloignée, comme suit : (K)2 (L)8 (M)18 (N)32 (O)25 (P)8 (Q)2. 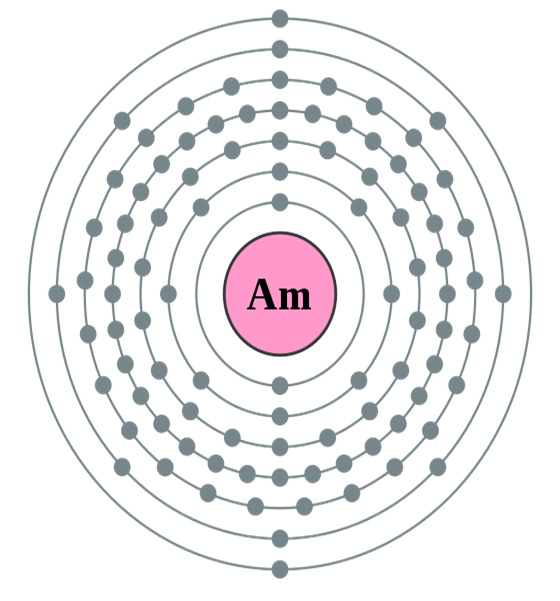
Américium et tableau périodique
Le numéro atomique de l’américium étant 95, il est positionné dans le tableau périodique entre le plutonium (94) et le curium (96). Ces éléments présentent d’ailleurs de nombreuses caractéristiques communes. 
Principales caractéristiques
Dans le tableau ci-dessous sont présentées les principales caractéristiques de l’américium.
| Caractéristiques | Données |
|---|---|
| Symbole | Am |
| Numéro atomique | 95 |
| Famille | Actinides |
| Groupe | - |
| Période | 7 |
| Bloc | f |
| Masse volumique | 13,69 g / cm3 à 20°C |
| Dureté | 80 Kp / mm² |
| Couleur | Blanc aux reflets argentés |
| Masse atomique | 241 u |
| Rayon atomique | 173 pm |
| Configuration électronique | (K)2 (L)8 (M)18 (N)32 (O)25 (P)8 (Q)2 |
| Etat ordinaire | Solide |
| Point de fusion | 1176°C |
| Point d'ébullition | 2011°C |
Isotopes
Il existe 18 isotopes connus pour l’américium, c’est-à-dire 18 « versions » d’américium différentes avec un nombre de masses variables. Les masses correspondent aux neutrons additionnés aux protons. Or le nombre de protons restant fixe (95 pour l’américium), c’est donc le nombre de neutrons qui varie d’un isotope à l’autre. Ainsi, il existe les isotopes de 231Am à 247Am. Toutefois, dans la nature, seuls sont présents ceux qui sont stables, c’est-à-dire les isotopes 241Am, 242Am et 243Am. Les isotopes 241Am, 242Am et 243Am sont fissiles.
L’américium 241 est le plus fréquemment rencontré (mais pas le plus stable) dans les centrales nucléaires car il est en équilibre avec le plutonium 241. Il se désintègre ensuite en neptunium 237.
L’américium 241 et 243 se décomposent respectivement en neptunium 237 et 239. Ce sont ces deux isotopes qui, de par leur durée de demi-vie relativement élevée, ont permis l’étude des propriétés chimiques de cet élément.
C’est plus particulièrement l’isotope 241 qui a permis d’acquérir la plupart des connaissances disponibles actuellement.
L’américium 242, quant à lui, se transforme pour atteindre un état stable dont la demi-vie sera de 16 heures pour ensuite potentiellement se transformer curium 242. La stabilité de l’isotope 241Am amène à une demi-vie de 432 ans ; tandis que l’isotope 242Am a une demi-vie de 141 ans, et l’isotope 243Am de 7370 ans. Les autres isotopes ont des demi-vies bien plus courtes, dont certaines inférieures à la seconde.
La demi-vie est donc très variable d’un isotope à l’autre de l’américium.
Remarque : Le temps de demi-vie est une estimation du temps nécessaire pour que la moitié d’une quantité d’un élément chimique soit désintégrée. Exemple : Si on dispose de 100 atomes de 241Am à T0, on estime qu’il restera 50 atomes à T1 = 216 ans.
Ressources en américium et fabrication
Ressources et abondance en américium
L’américium est un élément de synthèse. Il n’existe donc pas à l’état naturel dans l’environnement. Il peut être détecté dans les sols ou dans l’atmosphère suite à des accidents ou à des essais nucléaires uniquement.
Des recherches scientifiques ont toutefois permis de démontrer qu’il y avait eu une source naturelle d’américium 241 dans le réacteur nucléaire naturel d’Oklo au Gabon il y a environ deux milliards d’années.
Production d’américium
L’américium est produit dans les réacteurs nucléaires en bombardant du plutonium avec des neutrons. L’objectif initial de ces réacteurs est de produire de l’électricité, la production d’américium n’est donc qu’une conséquence, et non pas une finalité. Ainsi, ce n’est pas moins d’une tonne d’américium par an qui est produit en France.
Découverte de l’américium
Dans les années 1940, diverses expériences étaient menées en bombardant des isotopes de plutonium par des neutrons. C’est le cas notamment du plutonium 239 qui était soumis à des bombardements de neutrons dans des réacteurs nucléaires. Il se transformait alors en plutonium 240, puis en plutonium 241, provoquant alors la formation d’américium 241. C’est en 1944 que l’américium 241 fut identifié pour la première fois par A. Ghiorso, R. A. James, L. O. Morgan et G. T. Seaborg au laboratoire métallurgique de l’Université de Chicago. Toujours en 1944 et dans le même laboratoire, quelques mois après son identification, B. B. Cunningham parvint à isoler de l’américium 241. En 1951, E. F. Westrum et L. R. Eyring réussirent à produire quelques centaines de microgrammes de trifluorure d’américium 241 volontairement.
Applications de l’américium
Propriétés de l'américium
L’américium peut exister sous diverses formes qui correspondent à des composés chimiques variés dont les propriétés restent très similaires les unes aux autres, tels que le sulfure d’américium (AmS) ou encore le dioxyde d’américium (AmO2). L’américium est un métal de couleur blanche aux reflets argentés, relativement malléable, et notamment plus malléable que l’uranium ou que le neptunium.
Il se distingue des autres métaux par sa forte électronégativité.
Ce métal est un transuranien appartenant à la famille des actinides. Ainsi, comme l’actinium (représentant majeur des actinides), l’américium s’oxyde vite lorsqu’il est en contact avec l’oxygène de l’air.
La principale propriété de l’américium reste sa forte radioactivité, comme tous les autres éléments chimiques appartenant à la famille des actinides.
En solution aqueuse (dans un liquide comme l’eau par exemple), l’américium peut exister dans différents états oxydés, c’est alors l’état trivalent (III) qui est l’état le plus stable. A des pH neutres et / ou biologiques, l’américium est peu soluble en solution aqueuse : il a davantage tendance à s’hydrolyser.
Utilisations et applications
Bien que la forte radioactivité de l’américium complexifie grandement son utilisation, cet élément chimique est principalement utilisé dans les détecteurs de fumée et en tant que source de neutrons plus généralement.
On retrouve l’américium dans les détecteurs de fumée en très petites quantités, avec quelques dixièmes de milligramme seulement. Toutefois, ces détecteurs de fumée ne correspondent pas au modèle présent dans les ménages français. Ce sont principalement dans les installations industrielles qu’ils sont présents, mais ils sont de moins en moins utilisés car ils posent des problèmes de recyclage. Lorsqu’il se désintègre, l’américium 241 émet un rayonnement alpha qui va ioniser des molécules contenues dans la chambre de détection. Les ions et les électrons sont attirés selon leur charge par les deux électrodes (positive et négative) dans cette même chambre. 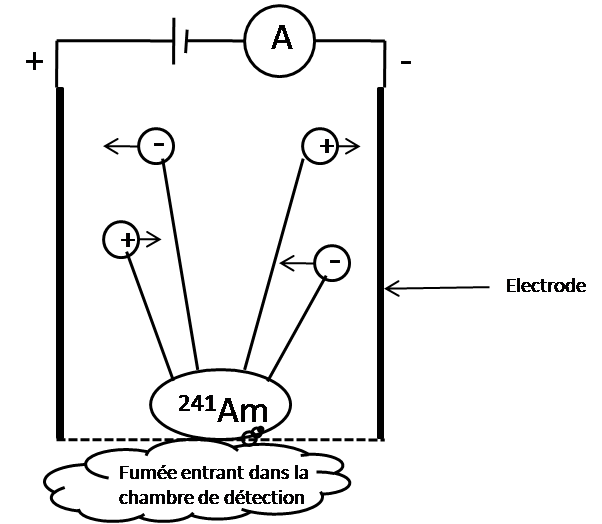
Effets sur la santé
L’américium, en raison de sa radioactivité, est potentiellement toxique. Ce sont les radiations qu’il émet qui sont à l’origine de sa toxicité probable. Des expériences ont montré que l’américium, une fois ingéré, se déplaçait rapidement dans le corps humain pour ensuite être stocké dans les os, le foie et les gonades (testicules et ovaires) pour une période moyenne de 20 ans.
Le principal risque consiste en des mutations de l’ADN, dont les effets peuvent être aussi divers que variés, et potentiellement transmissibles à la descendance. Certaines mutations peuvent amener à des cancers.
Ces effets sont valables pour tous les êtres vivants, c’est-à-dire aussi bien pour les animaux (dont les humains) que pour les plantes, avec les mêmes conséquences. Toutefois, il est important de souligner que les dommages causés au corps humain ne sont pas démontrés et sont considérés comme étant limités, avec une dose de tolérance estimée à 0,015 microgrammes d’américium 241 pour la totalité d’un corps d’Homme. L’américium se concentre au fil de la chaine alimentaire. Ainsi, des animaux et des humaines peuvent être soumis aux effets potentiellement néfastes de l’américium en consommant par exemple des plantes en ayant incorporé. Remarque : En cas d’exposition a de l’américium, on traite le patient par administration d’acide diethylène triamine pentaacétique.
Effets sur l’environnement
L’américium n’est pas présent dans la nature puisque c’est un élément synthétique, créé donc par l’Homme dans les réacteurs nucléaires.
C’est uniquement suite à des accidents nucléaires ou à des essais nucléaires qu’on peut le retrouver dans la nature, dans les sols et / ou dans l’atmosphère.
L’américium peut rester dans l’air (dans l’atmosphère) pendant plusieurs décennies, pouvant ainsi provoquer des problèmes aux poumons, au foie et à la thyroïde des animaux exposés.























Si vous désirez une aide personnalisée, contactez dès maintenant l’un de nos professeurs !