Chapitres

L'eau, un élément de base
L'eau peut se trouver sous ses 3 états à la surface de la Terre. En effet, elle est liquide dans nos rivières et lorsqu'on la boit, gazeuse dans l'air que nous respirons et dans la vapeur d'eau et pour finir solide sur les glaciers ou dans les glaçons.
Les différentes formes de l'eau

L'eau solide
L'eau atteint son état solide lorsque la température atteint ou descend les 0° C. Les molécules adoptent donc une structure cristalline.
L'eau liquide
On peut trouver de l'eau liquides dans les conditions climatiques habituelles de nos environnements de vie. En effet, sous pression atmosphérique normale de 1 bar et entre 0° C et 100° C, l'eau prend sa forme liquide. Elle adopte alors uns structure plus désordonnée et prends moins de place. C'est pourquoi l'eau gelée occupe plus de place que l'eau liquide.
L'eau gazeuse
La majorité de l'eau gazeuse est celle que nous respirons dans l'air. A pression normale de 1 bar et une fois passé la barre des 100° C, l'eau devient gazeuse et l'on parle alors de vapeur d'eau. C'est aussi l'état de l'eau qui s'évapore (au dessus des lacs, rivières ou océans). Les molécules d'eau sont dans leur état le plus agité lorsqu'elles sont gazeuses. L'attraction terrestre s'exerce alors moins dessus et permet au gaz de expanser.
Les origines de l'eau
Répartition de l'eau à la surface de la terre
L’eau est l’élément le plus répandu sur la planète mais aussi le constituant le plus important des êtres vivants.
L'Homme est en effet lui-même constitué de 70% d'eau).
97,5% de l'eau présente sur Terre est salée. Elle constitue donc les océans et les mers de notre planète. Au niveau des hémisphères, celui du nord comporte moins d'eau que celui du sud et toutes les étendues salées de ces deux hémisphères représentent 1350 millions de km3. Ils recouvrent donc les deux tiers de la planète.
Le reste de l'eau disponible sur Terre est de l'eau douce. Parmi ces dernières, 2,59% sont immobilisées par les eaux souterraines ou sous forme de glace (eau non directement disponible pour les êtres vivants). Les 0,1% restants représentent l'eau de surface et l'eau d'humidité du sol, ces dernières étant accessible des être vivants.
Le plus grand réservoir d'eau douce au monde est le lac Baïkal. Il se situe en Sibérie et représente 1/5 du réservoir mondial avec une profondeur plus de 1600 mètres.
Les ions, des molécules chargées
Un ion est un atome, qui à perdu ou gagné un ou plusieurs électrons (au maximum 3). Exemple, le lithium (Li) perd un électron il devient l'ion de lithium (Li+). Un autre exemple, le fluor (F) gagne un électron, il devient l'ion de fluor (F- ). Si un atome perd 2 électrons, imaginons que cette atome soit l'hydrogène (H), il devient l'ion d'hydrogène (H+2).
Un atome (ou groupe d'atomes) qui perd un ou plusieurs électrons devient une espèce chimiquement chargée appelée ion. La charge du noyau reste inchangée.
Un ion négatif est un atome (ou groupe d'atome) qui à gagné un ou plusieurs électrons. On l'appelle anion.
Un ion positif est un atome (ou groupe d'atome) qui à perdu un ou plusieurs électrons. On l'appelle cation.

Les cristaux ioniques
Les cristaux ioniques sont constitués d'anions et de cations tenus entre eux par l'attraction électrique. Cette attraction est responsable de la structure géométrique qu'adoptent les ions pour former un cristal. Un ion positif va s'entourer d'ions négatifs et réciproquement et de la même manière que les atomes ou molécules forment les solides, les ions forment les cristaux.
Exemple : Dans un cristal de chlorure de sodium NaCl, les ions adoptent une structure cubique où un anion est entouré de 6 cations. Un cristal ionique est toujours électriquement neutre donc il y a autant de charges positives que négatives. Par conséquent, certains cristaux possèdent plus d'anions et de cations (ou inversement).
Les ions étant jointifs, la distance qui les sépare correspond à la distance entre leur centre. La cohésion du cristal est due à l'interaction coulombienne qui correspond à la force qui lie deux ions. La valeur de cette force peut paraître faible mais elle est bien plus importante par rapport au poids de l'ion. A cette échelle, c'est la force électrique qui domine. La température de fusion des solides ioniques est assez élevée (801 °C) pour le sel, ce qui veut dire que les liaisons entre ions sont très solides.
La loi de Coulomb
Coulomb, un physicien français, a établi en 1758 que le champ doit varier comme le carré inverse de la distance entre les charges à une précision de 0,02 sur l'exposant avec l'aide d'un dispositif appelé balance de Coulomb. Cette balance est constituée d'un fil de torsion en argent sur lequel est fixé des matériaux chargés. Ainsi, la loi d'attraction entre deux charges ponctuelles notées q1 et q2 , fixes dans le référentiel défini et séparées par une distance r, se définit ainsi :
- La force est dirigée selon la droite reliant les deux charges ;
- Elle est attractive si les charges sont de signes opposée et répulsive sinon ;
- Son intensité est proportionnelle aux valeurs de q1 et q2 et varie en raison inverse du carré de la distance r.
Il est alors possible de traduire ces caractéristiques en une formule exprimant la force exercée par q1 sur q2 :  Avec :
Avec :
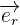 le vecteur unitaire de la droite reliant q1 et q2 qui est dirigée dans le sens 1 vers 2
le vecteur unitaire de la droite reliant q1 et q2 qui est dirigée dans le sens 1 vers 2 la permittivité diélectrique du vide
la permittivité diélectrique du vide
Ce qui peut rendre la compréhension de cette formule compliquée est la notion de force à distance. En effet, comment une charge peut savoir qu'une autre charge ponctuelle se trouve à une certaine distance d'elle et alors exercer sur force sur cette charge en fonction de la distance qui les sépare. Dans ce cas, tout comme pour un champ gravitationnel, il peut être utile de séparer dans la loi de force ce qui dépend de la charge subissant la force et donc d'obtenir la relation suivante : 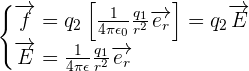 Avec :
Avec :
 un champ électrique électrostatique créé à partie de la charge q1 au point où se trouve la seconde charge q2
un champ électrique électrostatique créé à partie de la charge q1 au point où se trouve la seconde charge q2
Ainsi, avec cette relation, il est plus aisé d'interpréter l’existence d'une force à distance. En effet, la charge considérée comme "source", c'est-à-dire q1, crée en tout point de l'espace un champ électrique dont la forme est donnée par la relation exprimée ci-dessus, et une charge quelconque considérée comme "test" subira l'effet de ce champ sous la forme d'une force égale au produit de cette charge par le champ électrostatique. Dans ce cas, ce champ électrostatique apparaîtra comme la force entre deux particules ponctuelles fixes par unité de charge.
Les opérations chimiques aqueuses
L'électrolyse
C'est en 1800 que la toute première électrolyse a été réalisée par deux chimistes originaires de Londres, William Nicholson et Sir Anthony Carlisle. Ils réalisent une électrolyse de l'eau.
L'électrolyse met en jeu deux couples rédox. Il les fait réagir dan le sens contraire de la réaction naturelle au moyen d'un courant électrique qui apporte l'énergie nécessaire à la réaction.
Un électrolyseur est un dispositif consistant en une récipient contenant une solution ionique dans la quelle plongent deux électrodes.
Une électrolyse est une opération chimique dont le but est de décomposer différentes matières. Par exemple, lorsqu'une solution contient une matière, on va y ajouter un solvant afin que ses ions soit décomposables. On plonge alors ce mélange dans un bain auquel sont intégrés une anode et une cathode, faisant alors passer un courant dans le bain.
Les électrodes se polarisent dès que le courant passe :
- L'anode est l'électrode par laquelle le courant arrive dans le système. Les électrons en sortent donc. Il y a oxydation du réducteur. Elle est reliée au pôle + du générateur.
- La cathode est l'électrode par laquelle sort le courant c'est à dire par laquelle entrent les électrons. Il s'y produit. Elle est reliée au pôle - du générateur.
Contrairement aux piles vues dans le chapitre sur le potentiel standard, le dispositif d'électrolyse n'est pas polarisé par les couples rédox mais bien par le générateur branché à ses bornes.
L'électrolyte est le milieu conducteur, la solution ionique dans laquelle baignent les anions et les cations.
Les anions de l'électrolyte migrent vers l'électrode reliée au pôle + ( l'anode) et y subissent parfois une réaction d'oxydation.
Les cations de l'électrolyte migrent vers l'électrode reliée au pôle - ( c'est à dire la cathode)où ils peuvent subir une réduction.
Il peut enfin y avoir éventuellement oxydation ou réduction de l'eau (voir ci-dessous les couples rédox de l'eau).
Les participants potentiels aux échanges électroniques sont donc :
- Les ions positifs ou négatifs du bain électrolytique ;
- Les molécules du solvant ;
- Les matériaux constituant les électrodes.
L'électron est donc l'un des composants de l'atome au même titre que les neutrons et protons. C'est une particule élémentaire que l'on note petit e et dont la charge élémentaire est de signe négatif. Ils s'organisent autour du noyau de l'atome dans ce que l'on appelle un nuage électronique.
Les électrons et leurs propriétés ont aidé à la compréhension d'une multitude de phénomènes physiques, notamment en termes de conductivité.

Les dilutions
Des substances sont solubles avec une autre substance si elles forment avec elle un mélange homogène. Le corps mis en solution est un soluté. Le corps dans lequel le soluté est dissous est le solvant. Le mélange du soluté et du solvant est la solution.
Concentration molaire
La concentration molaire d’une solution met en rapport la quantité de matière dissoute et le volume de solvant dans lequel le soluté a été dissous. Elle se calcule comme suit :

avec C, concentration molaire en mol.l-1
n, quantité de matière dissoute en mol.
V, volume de solvant en litres
On peut facilement retrouver la quantité de soluté introduite à partir de la masse introduite et de la masse molaire du corps.
En effet, 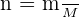
La concentration molaire ionique doit être calculée en fonction de la concentration molaire et des coefficients stœchiométriques de l’équation bilan. En effet, si la dissolution d’un atome donne naissance à deux ions, on aura Cion= 2. C.
La concentration molaire d’un ion i se note [i].
L’électroneutralité est la caractéristique constante d’une solution. En effet, la solution est obtenue par dissolution d’un soluté électriquement neutre et le nombre de moles de charges négatives dues aux anions est strictement égal au nombre de charges positives dues aux cations. Cette égalité est valide pour les quantités, elle l’est donc tout autant pour les concentrations molaires ioniques puisque le volume de solution est le même.
La préparation des solutions aqueuses ou leur dissolution doit suivre certaines procédures afin de ne pas aboutir à une solution dont la concentration nominale est erronée ( voir la fiche méthode en fin de leçon).
Le principe de la dissolution veut que, pour obtenir une solution fille Sf de concentration Cf, on dilue un volume Vm de la solution mère Sm de concentration Cm qui est nécessairement plus forte que celle de Sf. On ne peut évidemment pas aboutir par dissolution à une solution fille plus concentrée que la solution mère. Le volume de solution mère à dissoudre est à choisir judicieusement en fonction de la concentration de la solution que l’on désire obtenir et du volume de solution fille dont on souhaite disposer.
La loi de conservation chimique permet d’affirmer que la quantité de matière présente dans l’échantillon de la solution mère qui a été dissoute est toujours présente dans l’ensemble de la solution fille.

On peut mettre cette conservation sous forme mathématique en affirmant que :
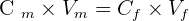
Un corps pur ionique contient au moins deux sortes d’ions : l’un positif, l’autre négatif. Ils sont toujours en quantités équivalents de sorte que le corps pur est électriquement neutre.
Entre ces ions règne un autre type de liaison que les liaison covalentes abordées l’an dernier. Il y a ce que l’on appelle une liaison ionique qui résulte de l’attraction entre les ions due aux charges électrostatiques.

La molécule d’eau se présente ainsi que le montre la figure ci-dessus. Elle est caractérisée par une polarité.
En effet, l’atome d’oxygène a des propriétés électronégatives qui font que les doublets le liant aux atomes d’hydrogène se déplacent vers l’atome d’oxygène. A l’opposé de l’atome d’oxygène, les deux doublets non-liants ne permettent pas de rééquilibrer la molécule par une charge positive.
Ainsi, si la molécule reste neutre électriquement, elle présente une charge négative de -2 sur l’atome d’oxygène et de +
sur l’atome d’oxygène et de + sur chacun des atomes d’hydrogène. On dit qu’elle est polaire.
sur chacun des atomes d’hydrogène. On dit qu’elle est polaire.

Ce sont ces propriétés qui font que l’eau parvient à briser la liaison ionique et à les disperser. En effet, les ions positifs attirent l’atome d’oxygène de la molécule d’eau puisqu’il est porteur de la charge –2 . Les ions négatifs, eux sont attirés par les atomes d’hydrogènes qui sont porteurs de la charge partielle +
. Les ions négatifs, eux sont attirés par les atomes d’hydrogènes qui sont porteurs de la charge partielle + . On arrive à une solution qui peut-être schématisée ainsi :
. On arrive à une solution qui peut-être schématisée ainsi :

Cette interaction du solvant et des ions est appelée solvatation des ions, dans le cas d’un solvant eau, on l’appelle aussi hydratation. L'équation bilan d'une hydratation se présente comme ceci :

On distingue les substances hydrophobes qui ne sont pas solubles dans l’eau des substances hydrophiles qui le sont. Ces derniers sont des molécules polaires alors que les substances non solubles sont des molécules apolaires.
Les composés moléculaires subissent une dissolution avec ionisation. Trois grandes réactions peuvent intervenir : une formation de solution acide, une formation de solution basique ou une ionisation simple. Dans ces trois cas, l’ionisation peut être totale ou partielle.
Une molécule de soluté peut abandonner un ou plusieurs protons qui sera(ont) capturé par le doublet non liant de l’atome d’oxygène de la molécule d’eau ( la charge partielle négative). On arrive donc à une équation bilan du type :

Il y a bien création d’une solution acide ( ions H3O+)
A contrario, le solvant eau peut être amené à céder un proton qui sera capté par un doublet non liant de la molécule de soluté. Dans ce cas là, on débouche sur une molécule OH- qui est le propre des solutions basiques :
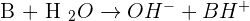
On dit que l’ionisation est totale si toutes les molécules de soluté introduites dans l’eau ont participé à l’ionisation c’est à dire qu’il n’en reste aucun sous forme initiale. Cette ionisation totale est constatée dans l’équation-bilan par une flèche unique vers la droite.
En revanche, s’il reste des molécules de soluté dans la solution, c’est qu’une partie seulement du soluté a subi l’ionisation. Dans ce cas, on parle d’ionisation partielle, qui se traduit par une flèche à double sens.
N.B. :Dans les deux cas des dissolution ioniques et de composés moléculaires, il y a des conséquences thermiques qui seront traitées dans le cadres de la leçon sur la calorimétrie des réactions chimiques.
Il faut noter que la solubilité n’est pas identique pour tous les ions et tous les composés moléculaires : on appelle limite de solubilité ou solubilité la masse m maximale de soluté qui peut se dissoudre dans un litre de solvant donné. On dit alors que la solution est saturée. On considère que le soluté n’est pas soluble si cette valeur est inférieure à 0, 01 mol.l-1.
Fiche - Méthode : la dissolution en T.P.
Pour réaliser un dissolution au dixième ( c’est à dire obtenir une solution titrant le dixième de la concentration de la solution mère :
- Laver soigneusement la verrerie à l’eau distillée et le sécher parfaitement ( une verrerie non lavée peut contenir des traces de produits qui fausseront la concentration, un résidu d’eau impure en fera autant) ;
- Prélever un volume de 10 ml de la solution mère avec une pipette graduée en s’aidant le cas échéant d’une pro-pipette ;
- L’introduire dans une fiole jaugée de 100 ml ;
- Compléter jusqu’au trait de jauge avec de l’eau distillée ;
- Il convient de bien mélanger afin d’obtenir une solution homogène.
Les difficultés de la leçon :
Ce qu’il faut savoir :
- La loi de conservation et son application ;
- Les formules de la masse en fonction de la quantité et réciproquement ( en faisant intervenir la masse molaire) : le cours de seconde est considéré comme acquis.
Ce qu’il faut savoir faire :
- Décrire un TP ;
- Equilibrer une équation-bilan ;
- Réaliser des calculs sans se tromper dans les unités ( conversion des mL en L et des cm3 et L ) ;
- Raisonner logiquement et par étape ( calculer la quantité dissoute puis la concentration de la solution mère puis la quantité présente dans l’échantillon prélevé, puis la concentration de la solution fille, …
Exercice : Le piégeage du dioxyde de carbone
Le développement des technologies de piégeage et stockage du dioxyde de carbone (gaz à effet de serre) est indispensable pour atténuer la concentration en dioxyde de carbone dans l’atmosphère (rapport complémentaire du GIEC, 2014).
Le projet expérimental Carbfix étudie le piégeage du dioxyde de carbone produit par la centrale électrique de Hellisheidi (Islande). La méthode utilisée par Carbfix consiste à dissoudre le dioxyde de carbone dans de l’eau et à le piéger dans des roches basaltiques.
1. Solubilité du dioxyde de carbone dans l’eau de mer
Dans le cadre de l’expérience Carbfix, on étudie la possibilité de dissoudre le dioxyde de carbone dans l’eau de mer dans différentes conditions physico-chimiques. L’eau de mer sera considérée ici comme une solution aqueuse de chlorure de sodium à 0,5 mol par kilogramme d’eau.

1.1. À une température de 45°C et sous une pression en CO2 de 47 bar, déterminer la quantité maximale de dioxyde de carbone que l’on peut dissoudre dans un litre d’eau de mer.
1.2. Dans les mêmes conditions de température et de pression en CO2, en déduire le volume d’eau de mer nécessaire pour dissoudre 1 mole de dioxyde de carbone.
1.3. À partir des documents fournis, indiquer le sens dans lequel il semble préférable de modifier les paramètres température, pression en CO2 et teneur en chlorure de sodium de l’eau utilisée pour minimiser le volume d’eau nécessaire pour réaliser cette dissolution. Justifier brièvement.
2. Piégeage dans le cadre du projet CarbFix
Quand le dioxyde de carbone dissous dans l’eau entre en contact avec les roches basaltiques, diverses transformations chimiques interviennent et le consomment. Le piégeage du dioxyde de carbone (CO2) par ce procédé est prometteur puisqu’il est rapide et sûr. Cependant il consomme encore trop d’eau : un millier de piscines olympiques serait nécessaire pour piéger le CO2 produit en un an par la centrale de Hellisheidi !
On se propose de vérifier cette information en évaluant la quantité d’eau nécessaire pour ce piégeage. Dans la suite de l’exercice, le dioxyde de carbone dissous dans l’eau sera noté CO2(aq) pour simplifier l’écriture des équations de réactions.
Processus chimique de minéralisation du dioxyde de carbone dans le projet CarbFix
Le dioxyde de carbone gazeux CO2(g) est dissous dans un courant d’eau qui est injecté en profondeur dans des roches basaltiques. Le pH de cette solution aqueuse chargée en CO2(aq) est d’environ 3,5. Le dioxyde de carbone dissous réagit alors avec le basalte formant des ions hydrogénocarbonate HCO3− et des cations métalliques qui réagissent alors avec les ions pour former divers minéraux carbonatés solides.
Données :
- Couple acide-base CO2 (aq) / HCO3− (aq) de pKa = 6,35 à 25 °C ;
- Masse molaire du dioxyde de carbone CO2 : 44,0 g.mol-1;
- Dimensions d’une piscine olympique :
- longueur : L = 50 m ; largeur : ℓ = 25 m ; profondeur : h = 3 m ;
- On estimera qu’au moment de son injection dans la roche, la solution aqueuse de dioxyde de carbone a une concentration molaire C en CO2 (aq) et un pH reliés par la formule suivante :

Déterminer le volume d’eau nécessaire pour minéraliser les 40 000 tonnes de dioxyde de carbone gazeux produit par la centrale électrique en un an. Comparer avec l’estimation donnée dans le texte présentant le procédé Carbfix.























Si vous désirez une aide personnalisée, contactez dès maintenant l’un de nos professeurs !