Chapitres

Les différentes formes d'énergies

L'énergie est un grandeur difficile à définir, on peut dire cependant que l'énergie caractérise l'état d'un système et exprime la potentialité à modifier l'état d'un autre système avec lequel il est en interaction. L'énergie peut alors se présenter sous différentes formes, dont :
- L'énergie cinétique
- Tout corps en mouvement en possède une. Elle peut être macroscopique : elle dépend alors de la vitesse du corps en mouvement, et donc du référentiel d'étude microscopique : elle est liée à l'agitation moléculaire. Une augmentation de l'énergie cinétique microscopique se traduit par une augmentation de la température.
- L'énergie potentielle
- Elle dépend de la position relative des différentes parties du système: seul un systèmes déformable pourra posséder, à l'échelle macroscopique, de l'énergie potentielle.
Principe

Un système isolé est rigoureusement un système qui n'échange ni matière, ni énergie avec l'extérieur. L'énergie totale d'un système isolé est donc constante.
Les différentes formes d'énergie du système sont l'énergie potentielle de pesanteur (notée Ep) et l'énergie cinétique (notée Ec). L'énergie totale Et du système s'écrit donc : 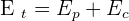
Prenons l'exemple de la chute libre d'une bille.
- Avant la chute, le système possède une énergie potentielle Ep mais aucune énergie cinétique Ec=0 car la vitesse est nulle dans le référentiel terrestre.
- Au cours de la chute, l'énergie potentielle Ep diminue car l'altitude de la bille par rapport au sol diminue, tandis que l'énergie cinétique augmente car la vitesse de la bille augmente.
- Au sol, l'énergie potentielle Ep =0 tandis que l'énergie cinétique est maximale.
On peut donc dire que les différentes formes d'énergie se transforment les unes en les autres. Si l'énergie totale du système n'est pas constante, le système n'est pas isolé.
En l'absence de frottement le système est isolé soit : 
On peut prendre l'exemple le fonctionnement d'un circuit électrique :
- Les réactifs chimique de la pile constituent un réservoir
- La pile en elle-même est un convertisseur d'énergie : elle convertit l'énergie chimique en énergie électrique
- La lampe est aussi un convertisseur d'énergie : elle convertit de l'énergie électrique en énergie rayonnante et en chaleur
- L'environnement constitue un réservoir d'énergie (chaleur)
Ceci constitue une chaîne énergétique. On représentera les réservoirs par des rectangles, les convertisseurs par des cercles et les transferts énergétique par des flèches.
L'aide d'un professeur physique chimie peut aider un élève à progresser.
Transfert d'énergie par rayonnement

Exemple : une plante réalisent la synthèse chlorophyllienne à l'aide de l'énergie rayonnante reçue du soleil.
L'énergie rayonnante est notée Wr et s'exprime en Joules (J)
Transfert d'énergie par travail
Exemple : lorsqu'on pousse une voiture on doit fournir un travail mécanique noté Wm et qui s'exprime en Joules
Relation travail - puissance. Un travail peut être réalisé plus ou moins rapidement. On définit alors la notion de puissance P
Exemple : Si pour pousser une voiture le travail a fournir est de 500 J en 5 s il faut développer une puissance mécanique 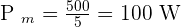
Exemple : la puissance électrique d'un récepteur est 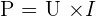
Transfert d'énergie par chaleur
Un transfert d'énergie par chaleur se manifeste de deux manières :
- Par une variation de température
- Par un changement d'état à température constante
Ce qu'on appelle transfert thermique en sciences est plus couramment appelé chaleur dans la vie quotidienne. Un transfert thermique correspond à l'un des modes d'échange d'énergie thermique entre deux systèmes. Dans le cas du double vitrage, on parlera du système extérieur et du système intérieur (la maison). Cela correspond à une notion fondamentale de la thermodynamique et, contrairement au travail, les transferts thermiques correspondent à un bilan de transferts d'énergie dits microscopiques et désordonnées.
Il est possible de distinguer trois type de transfert thermique, tous pouvant coexister :
- La conduction correspond à la diffusion progressive de l'agitation thermique dans la matière ;
- La convection correspond au transfert thermique qui accompagne des déplacements macroscopiques de la matières ;
- Et le rayonnement qui correspond à la propagation de photons.
Ainsi, la quantité de chaleur, notée Q et exprimée en joule, correspond à la quantité d'énergie qui sera échangée par le moyen de ces trois différents type de transfert. Une convention indique alors que, lorsque Q > 0, on dit que le système reçoit de l'énergie. De plus, il peut être intéressant de retenir que la thermodynamique fait appel au concept de chaleur afin de mettre en place le premier mais aussi de deuxième principe de la thermodynamique.
Malgré tout cela, il reste de nombreuses ambiguïtés mais également de nombreuses confusions qui s'entretiennent. En effet, malgré le sens que l'on accorde à chaleur dans la vie quotidienne, le principe de chaleur au sens thermodynamique du mot n'a aucun lien avec la température. Cependant, il reste vrai que les transferts thermiques spontanées se font toujours du système le plus élevé en température vers le système le moins élevé en température même s'il reste possible de provoquer l'inverse grâce à une machine thermique comme un réfrigérateur.
Il est d'ailleurs intéressant de noter que, lorsqu'il y a un changement d'état, le corps pur ne changera pas de température bien qu'il échange de l'énergie sous forme de chaleur.
Les principes de la thermodynamique
Il est important de noter que le premier et le deuxième principe de la thermodynamique sont les plus importants, mais il peut tout de même intéressant de connaître les deux autres.
Le principe zéro de la thermodynamique
Ce principe concerne la notion d'équilibre thermique. Ainsi, il est à la base de la thermométrie et s'énonce ainsi : si deux systèmes sont en équilibre thermique avec un troisième, alors ils sont aussi ensemble en équilibre thermique.
Le premier principe de la thermodynamique
Egalement appelé principe de la conservation de l'énergie, ce principe affirme que l'énergie est toujours conservée. Formulé autrement, cela signifie que l'énergie totale d'un système isolé reste constante. Ainsi, les événements qui se produisent au sein du système isolé ne se traduisent donc que par des transformations de certaines formes d'énergie en d'autres formes d'énergie. Puisque l'énergie ne peut pas être produite en partant de rien, elle est présente en quantité invariable dans la nature. Elle ne peut donc que se transmettre d'un système à un autre : on ne crée par l'énergie, on la transforme.
Ce principe est également considéré comme étant une loi générale pour toutes les théories physiques, notamment en mécanique, électromagnétisme ou physique nucléaire puisqu'on ne lui a jamais trouvé la moindre exception même si des doutes peuvent subsister lorsque l'on étudie les désintégration radioactives.
De puis le théorème de Noether, on sait que la conservation de l'énergie est intimement reliée à une uniformité de structure de l'espace-temps.
Le premier principe de la thermodynamique rejoint alors le célèbre principe popularisé par Lavoisier : "Rien ne se perd, rien ne se crée, tout se transforme."
Le deuxième principe de la thermodynamique
Egalement appelé principe d'évolution des système, ce principe affirme la dégradation de l'énergie. En effet, l'énergie d'un système passe de façon nécessaire et spontanée de formes concentrées et potentielles à des formes diffuses et cinétiques telles que le frottement ou la chaleur.
Ce principe introduit donc également la notion d'irréversibilité d'une transformation et la notion d'entropie. En effet, d'après le deuxième principe de la thermodynamique, l'entropie d'un système isolé augmente ou reste constante. Souvent interprété comme une mesure du désordre et comme l'impossibilité du passage du désordre à l'ordre sans intervention extérieur.
L'interprétation de ce principe se base sur la théorie de l'information de Claude Shannon et la mesure de cette information, également appelée entropie de Shannon.
La principale différence de ce principe avec le premier principe de la thermodynamique est l'origine statique de ce deuxième principe. En effet, les lois microscopiques qui gouvernent la matière ne le contiennent qu'implicitement et de manière statique. Cependant, le deuxième principe de la thermodynamique reste relativement indépendant des caractéristique des lois précédemment citée puisqu'il apparaît même si l'on suppose des lois simplistes à petite échelle.
Le troisième principe de la thermodynamique
Ce principe, quant à lui, est associé à la descente vers un état quantique fondamental d'un système dont la température s'approche d'une limite qui définit la notion de zéro absolu. En effet, en thermodynamique classique, ce principe permet de calculer l'entropie molaire S d'un corps pur par intégration sur la température à partir de S=0 à 0 K dans le but d'établir des tables de données thermodynamiques.
La loi de Laplace en thermodynamique
En thermodynamique, cette loi correspond à une relation reliant la pression et le volume d'un gaz parfait qui subit une transformation dite isentropique ou une transformation dite adiabatique et réversible. Mais cette relation peut également être utilisée avec la température et le volume ainsi que la température et la pression.
La loi de Laplace suppose en effet des capacités thermiques constante alors que les capacités thermiques d'un gaz parfait dépend évidemment de la température, il suffit de regarder la loi des gaz parfait. En conséquence, cette loi ne peut être appliquée à des transformation où la variation de la température est peu important. On peut alors considérer que les capacités thermiques sont constantes.

Avec :
- P est la pression d'un gaz (en pascals) ;
- V le volume occupé par le gaz (en m3) ;
- n la quantité de matière (en moles) ;
- R la constante universelle des gaz parfaits (8,3144621 J/K/mol) ;
- Et T est la température (en kelvins).
Transfert d'énergie par chaleur et contact
Si on considère A et B comme deux objets indéformables (donc δW = 0) qui forment à eux deux un système isolé (donc δQ = 0). Ainsi, si on se réfère au premier principe de la thermodynamique, on peut affirmer que la variation de l'énergie interne est égale à la somme de la chaleur et du travail. On a donc :

Ainsi, si on considère δQA et δQB comme étant les énergie thermiques élémentaires échangées entre l'objet A et l'objet B, on a donc : 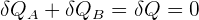
Et donc : 
Ensuite, si on suit le deuxième principe de la thermodynamique, il est possible d'écrire la relation suivante permettant de faire le lien entre les entropie des objets A et B :
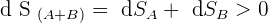
De plus, puisqu'il est indiqué que le système étudié est isolé, on sait par définition que : 
De ce fait, on a 
On peut alors en déduire que 
Ainsi, si δQA < 0 et donc que δQB > 0, alors on a TA > TB. De ce fait, en utilisant la règle des signes, on peut en conclure que l'objet A cède de la chaleur à l'objet B. On peut donc en conclure que l'objet le plus chaud cède de la chaleur à l'objet le plus froid.
Pour résumer la situation, dans le cas simple mettant en jeu un transfert thermique entre deux corps en contact avec des températures différentes, ce sera toujours le corps le plus chaud qui cédera de l'énergie thermique au corps le plus froid par conduction. Suite à cela, sa température va diminuer tout comme le désordre et l'agitation thermique. Cependant, pour le corps froid, la température et l'agitation thermique vont augmenter.
L'exemple le plus simple de situation mettant en jeu un transfert thermique est celui de deux corps en contact ayant des températures différentes. Le corps le plus chaud cède de l'énergie au corps le plus froid par conduction ; sa température diminue, le désordre, l'agitation thermique, diminue. En contrepartie, la température du corps froid augmente, l'agitation thermique augmente en son sein.
Transfert d'énergie par chaleur et variation de température
- Si Q>0 la chaleur est reçue par le système.
- Si Q<0 la chaleur est cédée par le système.
Transfert d'énergie par chaleur et changement d'état

Lors d'un changement d'état à température constante, la quantité d'énergie échangée correspond, de façon respective, pour une fusion, une vaporisation, une liquéfaction ou une solidification à : 
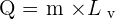
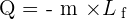
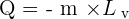
Avec :
- Q correspondant à la quantité d'énergie échangée en Joule (J) ;
- m correspondant à la masse du corps en kilogramme (kg) ;
- L correspondant à la chaleur latente de changement d'état.
Transfert d’énergie dans une chaîne énergétique
Dans une chaîne énergétique, les convertisseurs d'énergie transfère l'énergie reçue en d'autre formes d'énergie. Le rendement h d'un convertisseur est ainsi défini comme correspondant au rapport entre l'énergie utile fournie et l'énergie reçue.
De ce fait, moteur thermique correspond à un convertisseur d'énergie qui transforme une partie de l'énergie qu'il reçoit Q1 en travail mécanique Wm, l'autre partie de l'énergie reçue Q2 est transférée par chaleur dans le milieu extérieur.
Le travail électrique
Exemple : Un dipôle parcouru par un courant d'intensité I échange de l'énergie avec le reste du circuit.
Pendant la durée t, les forces électriques s'exerçant sur les charges qui traversent un dipôle AB, parcouru par un courant d'intensité I circulant de A vers B effectuent le travail : 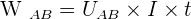
De par la définition de la puissance , il est possible de savoir que la puissance des forces électriques correspond à : 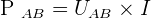
Ainsi, on sait que :
- Si la puissance est positive, alors le dipôle AB a reçu cette puissance.
- Si la puissance est négative, alors le dipôle AB a cédé cette puissance.
Avec :
- La tension U qui s'exprime en volt (V) ;
- L'intensité I qui s'exprime en ampère (A) ;
- Le temps t qui s'exprime en seconde (s) ;
- Le travail W qui s'exprime en joule (J) ;
- Et la puissance P qui s'exprime en watt (W).
On sait que, lorsqu'un dipôle est traversé par un courant, il y a transfert d'énergie entre le dipôle et le milieu ambiant.
De ce fait, lorsque le circuit est traversé par un courant d'intensité I, alors peu importe le dipôle présent au sein de ce circuit, celui-ci va s'échauffer. On appelle cela l'effet Joule. De ce fait, le dipôle qui sera ainsi échauffé va céder de l'énergie par chaleur au milieu ambiant.
On sait également que lorsqu'il le dipôle est traversé par un courant, alors celui-ci est capable d'effectuer un travail (on le considère alors comme un moteur électrique). Il cède alors de l'énergie au milieu ambiant par travail.
Par la même façon, lorsque le dipôle est traversé par un courant, alors celui-ci est capable d'émettre de la lumière (on le considère alors comme lampe électrique). Il cède alors de l'énergie au milieu ambiant.























Si vous désirez une aide personnalisée, contactez dès maintenant l’un de nos professeurs !