Chapitres

La dilution
Généralité

Cela semble tout de suite plus facile, n'est ce pas ?
La dilution correspond à un procédé qui consiste en l'obtention d'une solution finale qui présentera une concentration inférieure à la concentration de la solution de départ. Il est alors possible de procéder à cela grâce à un ajout de solvant ou encore en prélevant une partie de la solution puis de compléter jusqu'à atteindre le volume souhaité avec du solvant. Il est alors possible de caractériser une dilution par son taux de dilution. Mais pour cela, il est nécessaire de présupposer que le corps dilué est soluble dans le solvant qui est utilisé.
Dilution par ajout de solvant
On note la concentration d'une solution C et il est possible de la calculer avec la formule suivante :  Avec :
Avec :
- C la concentration molaire. Cette unité s'exprime en mol.L-1 ;
- n la quantité de matière du soluté en solution. Cette unité s'exprime en mol ;
- Et V le volume de solvant. Cette unité s'exprime en L.
Ainsi, si on procède à une dilution par ajout de solvant, la solution initiale et la solution finale contiennent autant de quantité de soluté. Cela signifie alors que ninitiale = nfinale . On a alors les relations suivantes qui se dégagent : 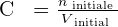

On peut déduire de ces relations le rapport suivant : 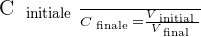

Taux de dilution
Il est possible d'exprimer le taux de dilution avec la relation suivante : 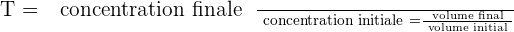 Il est important de savoir que le taux de dilution, noté T, est une grandeur sans unité et qui présente obligatoirement une valeur positive et inférieure à 1. Quant au taux de dilutions successives, il correspond au produit des taux de dilution de chaque dilution.
Il est important de savoir que le taux de dilution, noté T, est une grandeur sans unité et qui présente obligatoirement une valeur positive et inférieure à 1. Quant au taux de dilutions successives, il correspond au produit des taux de dilution de chaque dilution.
Exemple
Si on procède à une dilution à 3 % puis à 5 %, on a T qui est égal à : 
L'homéopathie et la dilution

L'homéopathie correspond à une pratique pseudo-scientifique de médecine alternative qui a été inventée en 1796 par Samuel Hahnemann. Cette pratique repose essentiellement sur le principe qu'il est possible de soigner un patient en diluant très fortement des substances qui, lorsqu'elles sont concentrées, pourraient provoquer des symptômes assez similaires à ceux que le patient rencontre. Or, au delà d'un certain nombre de dilutions, les remèdes se basant sur l'homéopathie sont totalement dépourvus de tout principes actifs. Afin de mettre au point un remède homéopathique, il est nécessaire d'utiliser la technique de dilutions infinitésimales. Ce principe consiste à diminuer la toxicité des substances choisies dans la composition du remède par application du principe de similitude. Suite à cela, il est nécessaire d'agiter très fortement les préparations. Ainsi, après chaque dilution, la préparation est secouée de façon énergique manuellement ou mécaniquement. Cela permettrait de conserver les effets pharmacologiques du principe malgré des dilutions importantes.
La mémoire de l'eau
Pour expliquer cette méthode, Jacques Benveniste, en 1987, mettra au point l'hypothèse de la mémoire de l'eau. Cette hypothèse reposerait sur la possibilité que l'eau garderait en mémoire les propriétés de la substances précédemment diluées même lorsque ces substances sont absente sous la forme d'une empreinte électromagnétique de la molécule. Cependant, cette hypothèse est considérée comme scientifiquement invraisemblable, et les précédentes démonstrations de cette hypothèse ne furent nullement convaincantes car truquées ou biaisées par la présence d'artefacts de manipulations.
La dilution et les dosages colorimétriques
Un dosage colorimétrique correspond à un type de dosage qu'il est possible de réaliser lorsqu'une réaction chimique donne des produits colorées et si l'intensité de la coloration est proportionnelle à la concentration de l'élément chimique à doser. Cette réaction repose donc logiquement sur la loi de Beer-Lambert. Notez qu'il est aussi possible de procéder à un dosage colorimétrique en utilisant des indicateurs colorés qui vont se colorer selon les variations de pH et donc indiquer le point d'équivalence de la réaction. Dans ce cas, on parle alors de titrage colorimétrique. Pour procéder à un tel dosage, il est alors nécessaire de procéder à la conception d'une gamme étalon.

Réaliser une gamme étalon
Conditions générales
Certains critères doivent être respectés pour effectuer un dosage colorimétrique :
- La réaction doit produire une teinte ou une opacité proportionnelle à la concentration.
- La teinte ou l'opacité doit être constante pendant le processus de mesure.
- Le composé à analyser doit être en concentration extrêmement faible (jamais dilué).
- Une gamme d'étalonnage doit être réalisée dans les mêmes circonstances physiques et chimiques que les expériences ;
- La longueur d'onde du spectrophotomètre doit être celle qui permet la plus grande absorption.
Si l'ensemble des ces conditions sont remplies, il est possible d'obtenir un dosage colorimétrique.
Protocole
Il est nécessaire de faire une gamme d'étalonnage afin de calibrer le spectrophotomètre (y compris pour certains kits vendus dans le commerce). Cette gamme permet de déterminer l'absorbance à une longueur d'onde donnée, pour un certain tube ou une certaine cuve de spectrophotomètre, pour une concentration de composé donnée. Par conséquent, il faut préparer une solution de dosage de l'élément à faible concentration. Le volume ultime de liquide dans chaque tube doit être le même afin d'obtenir la gamme d'étalonnage et de dosage. Ou, pour que la réaction se produise, les volumes des réactifs doivent rester constants, mais les quantités (liées aux concentrations) de composé à doser doivent varier dans chaque tube. Dans certaines méthodes de dosage, on complète avec de l'eau distillée afin d'atteindre un même volume (par exemple 100 ml) en ajustant le niveau à une jauge caractéristique.
Pour éliminer l'absorption causée par les réactifs eux-mêmes, il faut construire un tube 0 ou blanc. Ce tube ne contient aucun composé de dosage.
La création d'une gamme d'étalonnage nécessite une grande précision (utilisation de fioles jaugées, de pipettes, etc.) et doit être réalisée dans les mêmes conditions et par le même opérateur tout au long des manipulations.
Créer un tableau colorimétrique
La création d'une table colorimétrique permet d'éviter les erreurs lors de l'exécution du protocole et de l'enregistrement des résultats. Nous allons ici illustrer le cours avec un exemple de table colorimétrique pour un dosage de glucose par DNS.
| N° de tube | Solution étalon de glucose à 0,01 mol/L en mL | Prise d'essai en mL | Eau distillée en mL | DNS (réactif) en mL | Absorbance à 350 nm pour un tube/une cuve donné(e) | Quantité de glucose en µmol |
|---|---|---|---|---|---|---|
| 0 | 0 | 0 | 18,0 | 2,0 | 0 | 0 |
| 1 | 0,3 | 0 | 17,7 | 2,0 | 0,205 | 3,0 |
| 2 | 0,6 | 0 | 17,4 | 2,0 | 0,494 | 6,0 |
| 3 | 0,9 | 0 | 17,1 | 2,0 | 0,748 | 9,0 |
| 4 | 1,2 | 0 | 16,8 | 2,0 | 1,022 | 12,0 |
| 5 | 1,5 | 0 | 16,5 | 2,0 | 1,280 | 15,0 |
| x1 | 0 | 0,5 | 17,5 | 2,0 | 0,668 | 7,9 |
| x2 | 0 | 1,0 | 17,0 | 2,0 | 1,340 | Hors gamme |
Lire les résultats de l'analyse
Après avoir obtenu les valeurs d'absorbance de la gamme d'étalonnage, on représente la courbe d'absorption en fonction de la quantité (ou, plus couramment, de la concentration) du composé. Si la gamme a été bien réalisée (coefficient de corrélation supérieur à 99,95 %, par exemple), une droite devrait passer par l'origine du graphique et être proche de chaque point d'étalonnage.
Pour déterminer la quantité de composé présent, rapportez la valeur d'absorbance de l'expérience (la solution initiale peut avoir été microfiltrée). Pour remonter à la concentration initiale du composé à analyser, tenir compte du volume de l'échantillon et d'une éventuelle dilution.
Quelques conseils à suivre lors de votre prochain TP
Pendant la séance, travailler étape par étape
Un élève qui ne restitue que des tableaux de mesures sans les interpréter n’aura rien compris et se verra sanctionné par le professeur lors de la notation. On termine complètement, rédaction et conclusion incluses, une expérience avant de commencer la suivante.
Ne pas recopier l’énoncé
Inutile de recopier le texte de l’énoncé du TP ! Aucun professeur ne juge le travail d’un élève au poids de sa copie ! De plus, cela vous ferait perdre un temps précieux à la réalisation de vos expériences.
Par contre, doivent y figurer pour chaque expérience: un schéma clair qui explique la manipulation et les conditions expérimentales (attention, ce n’est pas un dessin d’art donc ne pas y passer trop de temps ), la théorie, les tableaux de valeurs avec les unités, le ou les graphes éventuels, les calculs éventuels et une conclusion.
Faire de beaux graphiques
Ne pas oublier d’indiquer le titre, les grandeurs correspondant à l’abscisse et l’ordonnée avec leur unité et l’échelle utilisée.
Les « points » seront préférentiellement des croix « droites »: trait horizontal + trait vertical bien visibles !
Si la courbe est censée être une droite, vérifier l’alignement des points (et le préciser dans le compte-rendu) et tracer une droite « moyenne ». Calculer son coefficient (sa pente), quasiment toujours utilisée pour conclure.
Exercices
Aide pour les exercices
Si vous disposez de 100 ml d'une solution de concentration 15 g/L. Comment devez-vous procéder si vous souhaitez transformer la solution de telle sorte qu'elle soit concentrée à 5 g/L. Pour diminuer la concentration d'une solution, il faut y ajouter du solvant. Il est alors nécessaire de tout d'abord commencer l'exercice en identifiant les données clairement. Cette étape doit toujours être présente lorsqu'il s'agit d'un problème où l'on diminue la concentration d'une solution.
Identification des données
- C1 = 15 g/L, cela correspond à la concentration initiale ;
- V1 = 100 mL, cette valeur correspond au volume initial ;
- C2 = 5 g/, cette valeur correspond alors à la concentration finale ;
- V2 = ? ce qui correspond au volume final de la solution.
Première façon de résoudre le problème
Tout d'abord, il est nécessaire de se demander de combien la concentration finale est plus petite que la concentration initiale. On procède au calcul suivant : 15 ÷ 5 = 3 permettant de déterminer que la concentration finale est 3 fois plus petite que la concentration initale. Ainsi, on déduit que le volume final doit être 3 fois plus grand que le volume initial. Donc, 3 x 100 ml = 300 ml. Le volume final doit donc être de 300 ml. Puisqu'on commence avec 100 ml, il ne reste qu'à ajouter 200 ml de solvant (300 ml - 100 ml) pour diminuer la concentration de notre solution.
Deuxième façon de résoudre le problème
- On utilise la relation suivante :
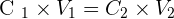
- On isole la variable inconnue, ici, le volume final afin d'obtenir :

- On remplace les chiffres dans l'équation en s'assurant que les unités de la concentration initiale et de la concentration finales soient identiques.
- On obtient alors : V2 = 300 ml (Les unités sont en ml puisque les g/L s'annulent entre eux.)
- Le volume final étant de 300 ml, on doit ajouter 200 ml de solvant à notre solution qui en contenait déjà 100 ml au départ.
Exercice n°1
Le Coca-Cola peut être considéré comme une solution contenant entre autres choses 0,25 mol.L-1 de saccharose (de formule C12H22O11). De plus, on sait qu'un morceau de sucre pèse environ 6 g. Combien de ces morceaux consomme-t-on lorsqu'on boit 33 cL de cette boisson ?
Exercice n°2
Un chimiste a préparé, dans des fioles jaugées de 100 mL quatre solutions différentes. Une fois toutes ces manipulations effectuées, le chimiste a voulu étiqueter ses fioles. Hélas, un ami est venu le distraire et il les a mélangées par inadvertance. Aidez-le retrouver la composition de chacune des fioles :
- une solution de glucose : sachant que la concentration de la solution de glucose est de 2 mol.L-1,
- Calculer la masse de glucose qui a été nécessaire à sa préparation.
- une solution de chlorure de sodium : le chimiste a introduit 18 g de chlorure de sodium dans une des fioles correspondantes et l'a complétée jusqu'au trait de jauge avec de l'eau distillée.
- Quelle est la concentration de la solution ainsi obtenue ?
- une solution d'amidon : le préparateur a prélevé 10 mL de solution d'un flacon marqué "solution d'amidon" de concentration 0,25 mol.L-1 ; il a introduit ces 10 mL dans la fiole jaugée puis l'a complétée jusqu'au trait de jauge avec de l'eau distillée.
- Quelle est la concentration de la solution ainsi obtenue ?
- une solution de saccharose : quatre morceaux de sucre de 6 g ont été introduits dans une autre fiole jaugée de 100 mL ; le chimiste l'a ensuite complétée jusqu'au trait de jauge avec de l'eau distillée.
- Quelle est la concentration de la solution ainsi obtenue ?
Exercice n°3
La vitamine C ou acide ascorbique (de formule C6H8O6) se trouve naturellement dans les aliments (végétaux frais, foie, salade, persil). Antiscorbutique, elle augmente la résistance aux infections et à la fatigue et agit dans l'ossification. Actuellement, les laboratoires pharmaceutiques proposent de la vitamine C de synthèse sous forme de comprimés. Par exemple, un comprimé de vitamine C "Juvamine" contient 1 mmol de vitamine C.
- Quelles différence y a-t-il entre la vitamine C de synthèse et la vitamine C issue de produits naturels ?
- Sachant que la proportion de vitamine C (en mg pour 100 g) est de 50 pour les oranges, 172 pour le persil et de 36 pour le foie de veau, combien faut-il consommer de ces aliments pour ingérer autant de vitamine qu'avec 1 comprimé de Juvamine ?
- On dilue 2 comprimés de Juvamine dans un 25 cL d'eau. On obtient unesolution d'acide ascorbique. Quelle est la concentration de cette solution ?
Exercice n°4
Pour doser une solution trop concentrée, on la dilue une première fois : on prélève 20 mL que l'on complète jusqu'à 100 mL. Puis on dilue à nouveau avec les mêmes proportions, la solution obtenue. La concentration de la solution finale est alors de C = 0,45 g/L Quelle était la concentration de la solution initiale ?
Exercice n°5
Une solution aqueuse a une concentration massique de 90 g/L. On prélève 20 mL de cette solution et on ajoute 40 mL d'eau. On suppose que les volumes s'additionnent. Quelle est la nouvelle concentration ?
Exercice n°6
On prélève un volume v0 = 20,0 mL d’une solution aqueuse de sulfate de cuivre II de concentration C0 =5,0 . 10-2 mol.L-1 Ce volume est introduit dans une fiole jaugée de 500 mL, on complète avec de l’eau distillée jusqu’au trait de jauge, puis on homogénéise :
- Comment prélève t on le volume V0 de la solution mère ?
- Quelle est la concentration de la solution fille ?
- On définira le taux de dilution T comme étant le rapport entre la concentration de la solution mère par la concentration de la solution fille
- Calculer le facteur de dilution F effectué.























Si vous désirez une aide personnalisée, contactez dès maintenant l’un de nos professeurs !
bonjour j’aurai besoin d’aide pour exercice 4 et 5 svp merci
ex4 : rappeler la relation entre le facteur de dilution F , Cfille, Cmère, V fille, V mère prélevé.
on dilue 5 fois une solution mère à la concentration C1 = 24g.L-1 en prélevant 10 ml de cette solution mère.
a) trouver la concentration C2 de la solution fille ?
b) en déduire le volume V2 de cette solution fille?
EX 5 : quel volume Vmère de solution mère doit on prélever afin de préparer 250ml de solution S à partir d’une solution S0 de concentration C= 4,5g.L-1 qui est 9 fois plus concentrée que la solution S? MERCI par avance
Bonjour, nous serions ravis de vous aider ! Avez-vous essayé de contacter l’un de nos professeurs ? Excellente journée ! 🙂
J’ai vraiment aimer votre cours
Dans le chapitre sur la dilution, n’y aurait-il pas une inversion sur le rapport des concentrations. J’aurai dit Ci/Cf=Vf/Vi, non ?
Je sui très ravis d’avoir appris beaucoup concernant la dilution, et j’ai la curiosité de voir la réponse guidée de ces différents exercices
Je fabrique des bonbons cependant l’arôme est trouble de par sa concentration. Je souhaite en diminuer la concentration. Actuellement, je suis donc à 50% d’arôme pour un volume de 20mL. Par la suite, je prélève 1,25mL de cette solution pour le mettre dans ma formule. Je souhaite faire une nouvelle solution à 35% d’arôme pour un volume de 20mL mais je dois augmenter la quantité à prélever de cette solution pour la mettre dans ma formule (pour que l’arôme soit toujours aussi fort). Comment puis-je faire ? Quels calculs ? Merci.
Je n’arrive pas à comprendre
Comment la concentration mère est plus petite que la concentration fille
la solution mere est inferieur a la solution fille car on a fait une dilution (c’est a dire ajouter )et quand on ajoute la concentration diminue
la concentration mere est inferieur a la concentration fille car on a fait une dilution ( c’est a dire ajouter ) et quand on ajoute la concentration diminue