Chapitres

L'atome, présentation et histoire
La découverte de l'atome
En 400 av JC, un philosophe grecque nommée Démocrite est le premier homme à penser que la matière est constitué de minuscules particules tellement petite que l'on ne peut les diviser d'où leur nom de atomos qui signifie indivisible en grec.
La première approche des électrons date de l'époque de la Grèce Antique. Ceux-ci avaient pris conscience qu'une certaine oléorésine, l'ambre était capable d'attirée des objets si elle était frottée avec de la fourrure. Sans le savoir, ils venait de découvrir l'électricité statique. Il s'agit du deuxième phénomène électrique dont l'Homme a pris conscience, juste après la foudre.
En 1269, un ingénieur militaire qui servait auprès du prince Charles Premier de Sicile, se mit à étudier le phénomène d'attirance ente des petits objets après qu'ils aient été frottés.
La découvert de l'atome est imputable à Ernest Rutherford. Durant le début des années 1910, il s'est attelé à comprendre la composition de l'atome. Il a alors déterminé que l'atome était constitué d'un noyau qui concentrait toute la charge positive et aussi presque toute la masse de l'atome. Ce noyau est entouré d'un nuage électronique composé d'électrons.
L'un de ses collègues de laboratoire, Niels Bohr, a quant à lui démontré que les états de l'électrons dépendaient de l'énergie déterminée par le nombre n de l'atome. C'est à lui qu'on doit la compréhension de l'émission d'un photon lors d'un passage à un état inférieur.
Les caractéristiques de l'atome
L'atome a des caractéristiques bien particulières. Dans cette partie, nous allons les découvrir.
La masse des électrons est négligeable devant celle du noyau. On dit que la masse d'un atome est concentrée dans son noyau
Sa charge électrique se calcule facilement
C'est la somme de la charge électrique + des particules du noyau et celle – des électrons. Cette somme est nulle. L'atome est donc électriquement neutre.
Les charges électriques étant les même, il y a autant d'électrons qui gravitent autour du noyau que de particules le constituant.
Par exemple, l'atome de carbone a 6 électrons et 6 protons dans son noyau.
La taille d'un atome
Elle est infiniment petite.
Le diamètre d'un atome vaut en moyenne 10-1 nm ( 1 nm = 10 -9 m ).
Le diamètre du noyau vaut en moyenne 10-6 nm.
Le noyau est 100 000 fois plus petit que l'atome.
Entre les électrons et le noyau, il n'y a que du vide. On parle alors de la structure lacunaire de l'atome.
La structure de l'atome
Le noyau d'un atome se compose d'éléments que l'on appelle les nucléons. Ce sont eux qui définissent le nombre de masse d'un atome.
Le nombre de masse d’un atome est le nombre de nucléons qu’il contient. Il s’agit donc de la somme du nombre de protons et du nombre de protons qui constituent le noyau de l’atome
Dans ces nucléons se trouvent des protons dont la charge est positive et des neutrons à charge neutre. Ces deux composants sont très fortement liés entre eux.
Le rayon d'un nucléon est d'environ 10-15 m alors que l'atome tout entier a un diamètre avoisinant les 10-10 m.
Pour que le noyau et les électrons restent stables entre eux. Ils sont donc liés par une énergie de liaison. Si ils ne sont pas bien liés entre eux, les atomes deviennent instables et se transforment. Ils sont donc radioactifs.
Il existe trois types de radioactivité.

Radioactivité gamma
La radioactivité gamma est un rayonnement provoqué par une désintégration gamma. Le plu souvent, ces désintégrations accompagnent des désintégrations alpha ou bêta. En effet, quand il émet un rayon alpha ou bêta, le noyau devient excité. Lors de l’émission d’un rayonnement électromagnétique gamma, le noyau peut donc redescendre à un état plus stable.
Radioactivité bêta
La radioactivité bêta est un type de désintégration radioactive où une particule bêta (électron ou positron) est émise. On parle de radioactivité bêta + quand un positron est émis mais on parle de radioactivité – quand c’est un électron qui est émis.
Radioactivité alpha
La radioactivité alpha est un rayonnement provoqué par une désintégration alpha qui est une désintégration radioactive où un noyau atomique éjecte une particule alpha qui se transforme en un autre noyau dont le nombre de masse est diminué de 4 et le numéro atomique de 2 à cause de la particule alpha manquante qui est analogue au noyau d’hélium 4.
Vous souhaitez trouver un prof physique chimie pour progresser en la matière ?
Stabilité du noyau
Certains noyaux qui ont une bonne énergie de liaison restent stables. En réalité, la stabilité n'existe pas vraiment. On considère qu'on atome est stable quand sa demie-vie est égale à 1033 années, soit la durée de vie du proton.
En conclusion, il n'existe aucun noyau qui soit réellement stable à l'échelle de l'Univers. Par exemple, le diamant que nous trouvons tous très solide et stable est instable à l'échelle de la Terre mais stable à l'échelle de l'Homme.
Liaisons entre atomes
Dans un solide moléculaire les atomes sont liés par des liaisons covalentes : les deux atomes mettent en commun leurs électrons célibataires pour créer un doublet liant.
Quand les deux atomes sont identiques, la paire d’électron qui relie les deux atomes est répartie équitablement entre les deux atomes. On dit alors que la molécule est apolaire.
Quand deux atomes qui mettent leurs électrons en jeu sont différents et qu’il existe une différence d’électronégativité significative entre ces deux atomes, la liaison est dire polarisée et on appelle ce type de molécule, molécule polaire.
Une liaison covalente est dite polarisée si les deux atomes qui sont liés ont des électronégativités très différentes. En effet, dans ce cas, un des deux atomes aura tendance à attirer les électrons, ce qui a pour effet de polariser la liaison. Plus la différence d’électronégativité est grande et plus la polarisation de la liaison sera importante. Il se forme ainsi une sorte de dipôle électrique.
Le décalage des électrons conduit à noter une charge partielle négative δ– sur l’atome le plus électronégatif et une charge partielle positive δ+ sur le moins électronégatif
La stabilité des structures électroniques est aussi impactée par l'électronégativité.
L’électronégativité d'un élément est sa capacité à attirer les électrons lors de la création de liaisons chimiques avec d'autres éléments
On peut trouver l'électronégativité d'un élément grâce à sa position dans le tableau périodique des éléments.
En effet il existe un lien entre la période et l'électronégativité.
Par exemple, en lisant le tableau de gauche à droite, sur une période, l'électronégativité augmente. Il en va de même si on lit le tableau de bas en haut par colonne.
La classification périodique des éléments, aussi appelée tableau de Mendeleïev, du nom de son créateur. C’est un chimiste russe qui en 1869 créa un tableau dont le but était de regrouper tous les éléments chimiques connus par points communs (groupes et familles par exemple). Il a souvent été ajusté et mis à jour depuis cette époque.
Sa dernière révision date de 2016 par l’UICPA (Union Internationale de Chimie Pure et Appliquée), une ONG suisse qui a pour but l’évolution de la physique-chimie. Le tableau périodique compte à ce jour 118 éléments.
Les couches électroniques
Les électrons d'un atome ou d'un ion se répartissent en couches électroniques. La première couche électronique est notée K, la seconde couche est notée L, la troisième M... Chacune de ces couches ne peut contenir qu'un nombre limité d'électrons : 2 électrons au maximum pour la couche K, 8 électrons pour la couche L et 18 électrons pour la couche M. Une couche électronique est saturé lorsqu'elle contient son nombre maximal d'électrons.
Cette dernière couche porte ce que l'on appelle les électrons de valence. Ce tableau récapitule les groupes et nombre d'électrons de valence selon ces derniers :
| Numéro de groupe | Groupe | Nombre d'électrons de valence |
|---|---|---|
| 1 | Métaux alcalins | 1 |
| 2 | Métaux alcalino-terreux | 2 |
| 13 | 3 | |
| 14 | 4 | |
| 15 | Pnictogènes | 5 |
| 16 | Chalcogènes | 6 |
| 17 | Halogènes | 7 |
| 18 | Gaz nobles | 8 A exception de l'Hélium qui en a 2 |
Formules électronique
La formule électronique d'un atome ou d'un ion décrit la répartition de ses électrons sur les différentes couches électroniques. Les électrons se placent d'abord sur la couche K. Lorsque celle-ci est saturée, les électrons restant occupent la couche L puis, si nécessaire, la couche M. La répartition électronique ainsi obtenue correspond à l'état le plus stable de l'atome ou de l'ion considéré, dit état fondamental.
La couche externe est la dernière couche électronique occupée.
Les électrons occupant la couche K sont les plus proches du noyau et les plus liés au noyau. Les électrons occupant la couche externe sont les plus éloignés du noyau et les moins liés au noyau.
Pour donner la formule électronique d'un atome ou d'un ion, on écrit la lettre représentant chacune des couches électroniques occupées en indiquant son nombre d'électrons en exposant ; les couches électroniques non occupées ne sont pas écrites.
L'ion, différences et points communs avec l'atome
Un ion est un atome, qui à perdu ou gagné un ou plusieurs électrons.
Un atome (ou groupe d'atomes) qui perd un ou plusieurs électrons devient une espèce chimiquement chargée appelée ion. La charge du noyau reste inchangée.
Un ion négatif est un atome (ou groupe d'atome) qui à gagné un ou plusieurs électrons. On nomme ce type d'ions anions.
Un ion positif est un atome (ou groupe d'atome) qui à perdu un ou plusieurs électrons. Ces ions se nommes cations.
Afin de trouver facilement leur charge, on ajoute en exposant la valeur de leur charge électrique. L'ion sodium se notera donc Na+.

Histoire de la découverte de l'ion
C'est Michael Faraday en 1834 qui énonce pour la première fois le nom d'ion. Au départ, pour lui, ce sont les éléments chimiques responsables de la conductivité électrique au sein des solutions.
Dans des recherches plus poussées en 1853, un physicien et chimiste allemand, Johan Wihelm Hittorf, commence à remarquer que les ions migrent plus ou moins vite vers les électrodes. Il donne alors aux ions un "nombre de transfert".
Quelques exemples d'ions
Le lithium (Li) perd un électron il devient l'ion de lithium (Li+). Un autre exemple, le fluor (F) gagne un électron, il devient l'ion de fluor (F-). Si un atome perd 2 électrons, imaginons que cette atome soit l'hydrogène (H), il devient l'ion d'hydrogène (H+2).
Le solide et les cristaux ioniques
Les cristaux ioniques sont constitués d'anions et de cations tenus entre eux par l'attraction électrique. Cette attraction est responsable de la structure géométrique qu'adoptent les ions pour former un cristal. Un ion positif va s'entourer d'ions négatifs et réciproquement et de la même manière que les atomes ou molécules forment les solides, les ions forment les cristaux.
Exemple :Dans un cristal de chlorure de sodium NaCl, les ions adoptent une structure cubique où un anion est entouré de 6 cations. Un cristal ionique est toujours électriquement neutre donc il y a autant de charges positives que négatives. Par conséquent, certains cristaux possèdent plus d'anions et de cations (ou inversement).
Les ions étant jointifs, la distance qui les sépare correspond à la distance entre leur centre. La cohésion du cristal est due à l'interaction coulombienne qui correspond à la force qui lie deux ions. La valeur de cette force peut paraître faible mais elle est bien plus importante par rapport au poids de l'ion. A cette échelle, c'est la force électrique qui domine. La température de fusion des solides ioniques est assez élevée (801 °C) pour le sel, ce qui veut dire que les liaisons entre ions sont très solides.

Exercices d'application
Exercice 1 : Le lait et les ions
Dans certaines étables la conductivité du lait de vache est mesurée, lors de la traite, afin de détecter une possible inflammation des mamelles (mammites) qui rend impropre la consommation du lait.
La conductivité du lait dépend essentiellement des concentrations en ions sodium Na+, potassium K+ et chlorure Cl-. Les mammites, en provoquant une élévation des concentrations en ions Na+ et Cl-, augmentent la conductivité du lait.
Dans le lait frais de vache, la concentration massique moyenne en ions chlorure se situe entre 0,8 g.L-1 et 1,2 g.L-1
Dans le cas de laits dits « mammiteux », la valeur moyenne est voisine de 1,4 g.L-1.
D’après un article de « l’Institut de l’Élevage »
On se propose, dans cet exercice, de mesurer par conductimétrie la concentration en ions chlorure dans un lait de vache afin de vérifier la qualité de ce lait.
Données :
Masse molaire atomique du chlore : 35,5 g.mol-1
Relation entre la conductance G d’une solution et sa conductivité s : G = k.s où k est une constante.
Expression de la conductivité s en fonction des concentrations molaires effectives [Xi] des espèces ioniques Xi en solution :
\[ \sigma = \sum _ i \lambda _ {i} \cdot [ X _ {i} ] \]
où li est la conductivité molaire ionique des ions Xi.
1. Principe du dosage
Dans un bécher, on verse un volume V0 = 200,0 mL d’une solution aqueuse de chlorure de potassium de concentration molaire en soluté apporté c0 = 3,0×10-3 mol.L-1. On immerge, dans cette solution, la cellule d’un conductimètre qui mesure la conductivité σ de la solution. On lit σ = 4,0×10-2 S.m-1 à la température ambiante.
1.1. La conductivité de cette solution est-elle différente si on augmente :
- La concentration de la solution en gardant le volume de cette solution constant (justifier la réponse) ?
- Le volume de la solution en gardant la concentration c0 de la solution constante (justifier la réponse) ?
1.2. Dans le volume V0 de la solution aqueuse de chlorure de potassium, on ajoute goutte à goutte une solution aqueuse de nitrate d’argent de concentration molaire en soluté apporté c = 0,080 mol.L-1. On note la valeur de la conductivité σ en fonction du volume V de solution de nitrate d’argent ajouté et on représente graphiquement σ en fonction de V. On obtient les points expérimentaux reportés sur le graphique ci-dessous :
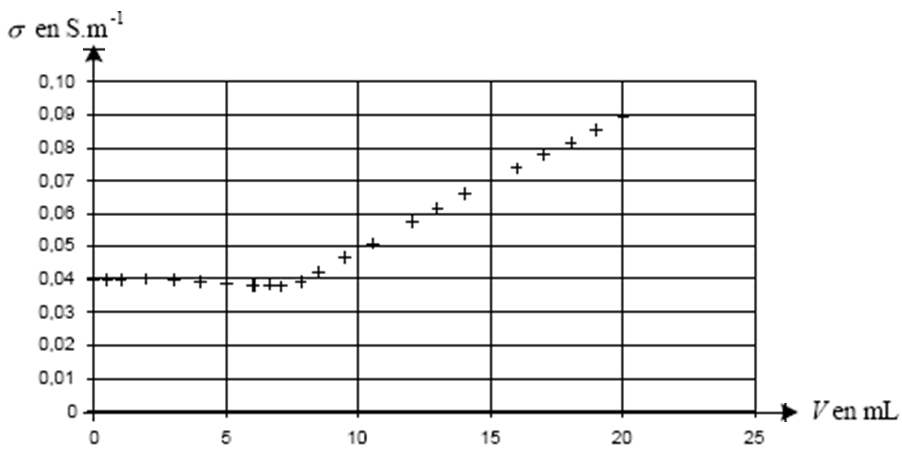
La transformation chimique est modélisée par la réaction entre les ions chlorure et les ions argent en solution aqueuse selon l’équation chimique :
Cl– (aq) + Ag+ (aq) = AgCl (s)
La constante d’équilibre K associée à cette équation a pour valeur, à 25°C, K = 5,0× 109
Pour savoir si cette transformation est totale, on étudie le mélange lorsque l’on a ajouté un volume V1 = 5,0 mL de solution aqueuse de nitrate d’argent.
1.2.1. Compléter le tableau d’évolution du système chimique de l’annexe, à rendre avec la copie en utilisant les expressions littérales.
1.2.2. À partir de ce tableau, déterminer l’expression de la constante d’équilibre K en fonction de c0, c, V0, V1 et de l’avancement final xf.
1.2.3. En utilisant la valeur numérique de K dans l’expression précédente, on peut déduire
xf = 4,0×10-4 mol. Le calcul de xf n’est pas demandé. Calculer le taux d’avancement final et conclure.
1.3. Donner la définition de l’équivalence lors d’un titrage.
1.4. Indiquer, sans justification, parmi les espèces ioniques suivantes :NO3–, K+, Ag+ et Cl-, celles qui sont présentes dans la solution :
- pour un volume V versé inférieur au volume versé à l’équivalence VE ?
- pour un volume V versé égal au volume versé à l’équivalence VE ?
- pour un volume V versé supérieur au volume versé à l’équivalence VE ?
1.5. Sachant que la conductivité molaire ionique λ1 des ions chlorure est légèrement supérieure à celle λ2 des ions nitrate, et en négligeant la variation de volume du mélange réactionnel au cours du titrage, justifier que :
- σ diminue légèrement avant d’avoir atteint l’équivalence ;
- σ augmente après avoir atteint l’équivalence.
1.6. Comment peut-on déterminer graphiquement le volume équivalent ?
2. Titrage des ions chlorure contenus dans le lait
On prélève, dans une bouteille de lait du commerce, un volume V0’ = 20,0 mL de lait frais que l’on introduit dans un becher. On y ajoute 250 mL d’eau distillée et quelques gouttes d’acide nitrique concentré. Soit S le mélange ainsi préparé. On observe la formation d’un précipité blanc : les protéines du lait précipitent en milieu acide et ainsi, ne peuvent plus réagir avec les ions argent Ag+(aq) et chlorure Cl-(aq). On introduit une sonde conductimétrique dans ce becher et, tout en agitant la solution, on note sa conductivité lors de l’ajout de la même solution titrante de nitrate d’argent qu’au 1.2 : solution aqueuse de nitrate d’argent de concentration molaire en soluté apporté c = 0,080 mol.L-1. On obtient les points expérimentaux reportés sur le graphique n°1 de l’annexe, à rendre avec la copie.
2.1. Expliquer pourquoi on doit éviter qu’il se produise une réaction entre les protéines du lait et les ions Ag+(aq) versés.
2.2. En exploitant le graphique n°1 de l’annexe, à rendre avec la copie, calculer la quantité d’ions chlorure contenus dans le prélèvement de volume V '0 = 20,0 mL de lait frais.
2.3. En déduire la masse d’ions chlorure contenue dans un litre de lait. Le lait étudié est-il «mammiteux» ?
Annexes
Tableau d'évolution
| Equation de la réaction | Ag+(aq) + Cl-(aq) = AgCl (s) | |||
|---|---|---|---|---|
| Etat du système | Avancement en mol | Quantité de matière en mol | ||
| Etat initial | 0 | n0(Ag+) = | n0(Cl-) = | 0 |
| Au cours de la transformation | x | |||
| Etat initial | xf | |||
Graphique n°1























Si vous désirez une aide personnalisée, contactez dès maintenant l’un de nos professeurs !