Chapitres
- 01. Le quotient de réaction ?
- 02. Expression du quotient de réaction ⚛️
- 03. Constante d’équilibre : définition ?
- 04. Quelle est la différence entre la constante d'équilibre et le quotient réactionnel ? ?
- 05. Les transformations chimiques ⚗️
- 06. Espèce chimique ?
- 07. L'avancement de la réaction chimique ??
- 08. Quotient de réaction : exercice ?
En sentiment comme en chimie, rien ne se crée, rien ne se perd.
Alfred Capus
➡️ Le quotient de réaction est un nombre qui exprime comment les concentrations des substances réactives et des produits dans une réaction chimique se comparent entre elles à un moment donné.
| Aspect | Description |
|---|---|
| Définition | Le quotient de réaction (Q) est une grandeur sans dimension évaluant la relation entre les concentrations des produits et des réactifs à un moment donné pendant une réaction chimique. |
| Formule Générale | Q = ([C]^c * [D]^d) / ([A]^a * [B]^b), où [A], [B], [C], et [D] sont les concentrations des espèces chimiques, et a, b, c, et d sont les coefficients stœchiométriques de la réaction. |
| Comparaison avec K | - Si Q < K, la réaction évolue vers la droite pour atteindre l'équilibre. - Si Q > K, la réaction évolue vers la gauche pour atteindre l'équilibre. - Si Q = K, la réaction est à l'équilibre. |
| Interprétation | Le quotient de réaction fournit des indications sur la direction dans laquelle la réaction évoluera pour atteindre l'équilibre, en comparant avec la constante d'équilibre (K). |
| Utilité | C'est un outil essentiel pour anticiper le comportement des réactions chimiques en fonction des concentrations des réactifs et des produits à différents stades de la réaction. |

Le quotient de réaction ?

En chimie, on note Qr le quotient de réaction.
Définition ?
? Le quotient de réaction est donc une mesure des concentrations relatives des réactifs et des produits dans une réaction chimique à un moment donné.
? Il est calculé en divisant le produit des concentrations des produits (chacune élevée à la puissance de son coefficient stœchiométrique dans l'équation chimique) par le produit des concentrations des réactifs (élevée à la puissance de leur coefficient stœchiométrique).
À quoi sert le quotient de réaction ? ?
Le quotient de réaction permet d'évaluer le déroulement d'une réaction par rapport à l'équilibre chimique. Il peut être utilisé pour prédire dans quelle direction la réaction va évoluer.
Exemple ➡️
Soit une transformation à laquelle est associée la réaction d'équation a A + b B = c C + d D.
Alors le quotient de réaction est le suivant : Qr = [C]c [D]d / ( [A]a [B]b )
Ce quotient a des limites définies comme ceci :
- Si [ C ] = [ D ] = 0 : Pas de réaction.
- Si [ A ] = [ B ] = 0 : Réaction totale ( Qr = + ∞ )
- Si Qr, e > 104 : on dit que la réaction est quasi-totale.
À l'équilibre, on note Qr = K = Qre.
Expression du quotient de réaction ⚛️
L'expression du quotient de réaction (Q) pour une réaction chimique
Q=[C]c⋅[D]d/[A]a⋅[B]b
Ici, A, B, C, et D représentent les concentrations molaires des espèces chimiques, et a, b, c, et d sont les coefficients stœchiométriques correspondants dans l'équation chimique équilibrée.
Constante d’équilibre : définition ?
La constante d'équilibre d'une réaction chimique est un nombre qui caractérise la position d'équilibre de cette réaction.
Elle est déterminée par les concentrations relatives des réactifs et des produits à l'état d'équilibre.
Plus simplement, la constante d'équilibre indique dans quelle mesure une réaction penche vers les réactifs ou les produits à un moment donné.

Quelle est la différence entre la constante d'équilibre et le quotient réactionnel ? ?
La constante d'équilibre (K) et le quotient réactionnel (Q) sont deux concepts liés aux réactions chimiques à l'équilibre, mais ils diffèrent par le moment auquel ils sont utilisés et par ce qu'ils indiquent.
Constante d'équilibre (K)
Utilisation : La constante d'équilibre est déterminée une fois que la réaction a atteint l'état d'équilibre, c'est-à-dire lorsque les taux d'avancement des réactifs et des produits ne changent plus.
Signification : Elle représente la relation entre les concentrations des réactifs et des produits à l'état d'équilibre. Un K élevé suggère une forte présence de produits, tandis qu'un K faible indique une prédominance des réactifs.
Quotient réactionnel (Q)
Utilisation : Le quotient réactionnel est calculé à n'importe quel moment de la réaction, pas nécessairement à l'équilibre.
Signification : Il permet d'évaluer la position actuelle de la réaction par rapport à l'équilibre en comparant les concentrations des réactifs et des produits. Si Q est égal à K, la réaction est à l'équilibre. Si Q est inférieur à K, la réaction évoluera vers la formation de produits, et si Q est supérieur à K, la réaction évoluera vers la formation de réactifs.
Le quotient de réaction est sans unité, car il est obtenu en divisant des concentrations molaires, dont les unités se simplifient dans le calcul.
➡️ En résumé, K est spécifique à l'état d'équilibre, tandis que Q est utilisé pour évaluer la progression de la réaction à n'importe quel moment. Lorsque Q est comparé à K, cela donne des indications sur la direction dans laquelle la réaction évoluera pour atteindre l'équilibre.
Les transformations chimiques ⚗️
Définition ?

Une transformation chimique, également appelée réaction chimique, est un processus au cours duquel une ou plusieurs substances, appelées réactifs, subissent des changements pour former de nouvelles substances, appelées produits.
Au cours de cette transformation, les liaisons entre les atomes sont rompues et formées.
Ces dernières entraînent une modification de la composition chimique des substances impliquées.
? Les réactions chimiques peuvent être décrites par des équations chimiques, qui représentent les réactifs à gauche de la flèche et les produits à droite, en respectant la conservation de la masse et de la charge.
Par ailleurs, elles sont souvent accompagnées de changements physiques tels que la libération ou l'absorption de chaleur, un changement de couleur, la formation de gaz, ou d'autres indications de modification de la matière à l'échelle moléculaire.
@mapetitemalledeveil Faire découvrir à vos enfants les réactions chimiques de façon simple et sereine ? #activity#activitésenfants#enfant#bebe#famille#réactionchimique#chimie#enfance#jouer#play#activities#activityforkids#forkids#kids#atelier#lait#colorantalimentaire#fun#PepsiApplePieChallenge ♬ FEEL THE GROOVE - Queens Road, Fabian Graetz
Exemples ➡️
Cuisson du pain :
- La pâte à pain crue subit des changements chimiques lorsqu'elle est cuite, et forme du pain grâce à la libération de dioxyde de carbone.
Digestion des aliments :
- Les enzymes dans le système digestif décomposent les aliments en molécules plus simples pour l'absorption par le corps.
Photosynthèse des plantes :
- Les plantes utilisent l'énergie solaire pour convertir le dioxyde de carbone et l'eau en glucose, et libèrent de l'oxygène.
Rouille du fer :
- L'exposition du fer à l'air et à l'humidité entraîne la formation d'oxyde de fer, communément appelé rouille.
Espèce chimique ?

Définition ?
Une espèce chimique se réfère à un type spécifique de substance chimique. Elle peut être définie par ses propres caractéristiques distinctives, comme sa composition chimique, sa structure moléculaire et ses propriétés.
Les espèces chimiques peuvent être des atomes, des molécules, des ions ou d'autres entités chimiques identifiables.
Exemple ➡️
Par exemple, l'eau (H₂O), le dioxyde de carbone (CO₂), le chlorure de sodium (NaCl), et l'oxygène (O₂) sont tous des exemples d'espèces chimiques distinctes.
Chaque espèce chimique a ses propres propriétés qui la différencient des autres, et elle peut participer à des réactions chimiques en se combinant avec d'autres espèces chimiques pour former de nouveaux composés.
L'avancement de la réaction chimique ??
@monsieurlechat94 video réalisée il y a quasi un mois, je ne sais pas ce qu'avait ma voix ce jour là ?? #chimie #lait ♬ Ambient - Zen Relaxation
➡️ Considérons la réaction chimique dont l'équation est : aA + bB ![]() cC + dD où A et B sont les réactifs, C et D les produits et a, b, c et d sont les nombres stœchiométriques.
cC + dD où A et B sont les réactifs, C et D les produits et a, b, c et d sont les nombres stœchiométriques.
Les notations utilisées dans la suite sont résumées ci-dessous :
- x : avancement de la réaction ;
- n(A)0 : quantité de matière initiale de A ;
- n(A) : quantité de matière de A à la date t ;
- n(A)f : quantité de matière finale de A.
Il en est de même pour les autres espèces.
Le taux d'avancement final d'une réaction chimique, exprimé en pourcentage, représente la proportion des réactifs qui ont réagi pour former les produits à la fin de la réaction. Par exemple, un taux d'avancement final de 80% signifie que 80% des réactifs initiaux ont participé à la formation des produits, tandis que les 20% restants n'ont pas réagi.
Pour suivre l'avancement d'une réaction, on utilise ce que l'on appelle un tableau d'avancement :
| Équation de la réaction | aA + bB cC + dD | |||
|---|---|---|---|---|
| Etat initial (mol) | n(A)0 | n(A)0 | n(C)0=0 | n(D)0=0 |
| Etat à l'instant T (mol) | n(A)=n(A)0-ax | n(B)=n(B)0-bx | n(C)=cx | n(D)=dx |
- On déduit la formule suivante :
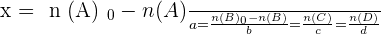
Par définition, la valeur commune x de ces rapports est appelée avancement de la réaction.
- Г = xf / xmax
- Г = 1 ( 100% ) si la réaction est totale.
- Г < 1 si la réaction est partielle (état d'équilibre)
Lorsque la concentration initiale diminue, le taux de réaction Г augmente, donc plus la réaction avance.
À concentration égale, le taux de réaction diffère selon la nature de l'acide.
➡️ Par exemple, prenons cette réaction :
H3-COOH + H2O = CH3COO- + H3O+
La réaction nécessite des chocs efficaces entre les réactifs : à t = 0, la concentration en réactif est importante, donc la réaction démarre très rapidement.
À t, la concentration en réactif diminue, la réaction ralentie. Entre T=0 et, la concentration des produits augmente. Cette réaction inverse s'accélère.
Lorsque les deux réactions se compensent exactement, c'est-à-dire que les deux vitesses sont équivalentes, l'équilibre est atteint et les concentrations des différentes espèces restent constantes.
Quotient de réaction : exercice ?
| Considérons la réaction chimique : | X + Y ⇌ Z | ||
|---|---|---|---|
| Coefficients stœchiométriques : | a = 1; b = 1; c = 1 | ||
| Étape | Concentrations initiales (mol/L) | Variations (mol/L) | Concentrations finales (mol/L) |
| 1 | [X] = 0.80, [Y] = 0.40, [Z] = 0.00 | -a, -b, +2c | [X] = 0.80-a, [Y] = 0.40-b, [Z] = 2c |
| Calculs : | Q = 2c / ((0.80-a) * (0.40-b)) | ||
| Comparaison avec la constante d'équilibre (K) : | Si Q > K, la réaction évoluera vers les réactifs. Si Q < K, la réaction évoluera vers les produits. Si Q = K, la réaction est à l'équilibre. |
À présent, c'est à vous de jouer !























Si vous désirez une aide personnalisée, contactez dès maintenant l’un de nos professeurs !