Chapitres
- 01. Rappels de cours
- 02. Exercices

Rappels de cours
Pour bien vous exercer, il est important de bien connaître les bases en ce qui concerne l'avancement des équations.
Considérons la réaction chimique dont l'équation est: aA + bB ![]() cC + dD où A et B sont les réactifs, C et D les produits et a, b, c et d sont les nombres stœchiométriques.
cC + dD où A et B sont les réactifs, C et D les produits et a, b, c et d sont les nombres stœchiométriques.
Les notations utilisées dans la suite sont résumées ci-dessous:
- x : avancement de la réaction ;
- n(A)0 : quantité de matière initiale de A ;
- n(A) : quantité de matière de A à la date t ;
- n(A)f : quantité de matière finale de A.
Il en est de même pour les autres espèces.
Il existe un calcul, celui de la vitesse volumique de réaction, qui permet de définir la vitesse à laquelle une réaction chimique s'effectue.

Elle se calcule comme ceci :
\[ v = \frac {ab} {cd} \frac { \text {d} x } { \text {d} t} \]
avec :
- v : vitesse volumique de réaction (en mol.m-3.s-1) ;
- V : volume de la solution (en m3) ;
- dx : variation de l'avancement (en mol) ;
- dt : durée de la variation (en s).
Exercices
Exercice 1 : Une réaction d'oxydo-réduction
On introduit un morceau de magnésium de masse m=1,2g de magnésium dans 1,00L d’acide chlorhydrique de concentration c = 2,0 * 10-1 mol/L. Il s’ensuit une réaction d’oxydoréduction, dans laquelle le magnésium réduit l’ion hydrogène, H+ (aq).
On détermine par une méthode appropriée la concentration en ions magnésium, [ Mg2+ ], à des dates déterminées, on obtient les résultats suivants.
| T (s) | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 100 |
|---|---|---|---|---|---|---|---|---|
| 0 | 0 | 2,0 | 3,0 | 3,7 | 4,4 | 4,8 | 4,9 | 4,9 |
1. Le magnésium et l’ion hydrogène appartienne nt respectivement aux couples oxydant réducteurs Mg 2+ (aq) /Mg(s) et H+(aq)/H2 (g), écrire les deux demi-équations électroniques relatives aux deux couples oxydant-réducteur.
2. Etablir l’équation de la réaction et en déduire la nature du gaz qui se dégage. Comment pourrait on le mettre en évidence ?
3. Tracer la courbe traduisant l’évolution de la concentration en ion magnésium au cours du temps .
4.Calculer les quantités de matière initiales des réactifs. Quel est le réactif limitant ?
5. Compléter le tableau descriptif de l’évolution du système réactionnel en fonction des quantités de matière initiale des réactifs et de l’avancement, x, de la réaction.
Donnée : MMg = 24.3 g/mol
| Date (s) | Avancement (mol) | nMg (mol) | nH+ (mol) | nMg2+ (mol) | nH2 (mol) |
|---|---|---|---|---|---|
| T=0 | 0 | n0 = ? | n'0 = ? | 0 | 0 |
| T | x | ? | ? | x | ? |
| t ∞ | xmax | ? | ? | ? | ? |
6. Quel est le réactifs limitant ? En déduire, d’après la courbe, le temps de demi réaction ?
7. Montrer que la vitesse volumique de la réaction peut se mettre sous la forme :
Vt = (d[Mg2+] )/ dt
8. En examinant le tableau des mesures, indiquer comment évolue la vitesse volumique de la réaction. Comment pouvait on prédire ce résultat à partir de la courbe ?
Exercice 2 : Titrage avec une réaction lente
On souhaite déterminer la concentration Ccom en peroxyde d’hydrogène (ou eau oxygénée) contenue dans une solution commerciale.
Pour cela, on se propose d’étudier la réaction entre les ions iodure I– et le peroxyde d’hydrogène H2O2 en milieu acide. Cette réaction est lente et totale.
Ces deux espèces chimiques appartiennent aux couples d’oxydoréduction I2(aq) / I–(aq) et H2O2(aq) / H2O(l). Parmi ces espèces, seul le diiode est coloré (jaune) en solution aqueuse. L’étude de la cinétique se fait par spectrophotométrie.

Étude de la réaction d’oxydoréduction et préparation de la solution :
1.1. Écrire les demi-équations d’oxydoréduction des deux couples étudiés.
1.2. En déduire que la réaction entre ces deux couples a pour équation :
H2O2(aq) + 2 I–(aq) + 2 H+(aq) = I2(aq) + 2 H2O(l).
1.3. Comment évolue la coloration de la solution au cours du temps ?
1.4. Avant de faire réagir la solution commerciale d’eau oxygénée, on souhaite la diluer d’un facteur 10. Donner les principales étapes du protocole opératoire afin de préparer V2 = 50 mL d’une solution d’eau oxygénée de concentration C2 = CCOM / 10.
2. Étude d’une transformation par spectrophotométrie
2.1. On utilise le spectrophotomètre pour réaliser la mesure de l’absorbance d’une solution aqueuse de diiode de concentration C0 = 1,0.10-2 mol.L-1. On mesure alors une absorbance A0 = 0,60. Sachant que l’absorbance A est proportionnelle à la concentration en diiode, déterminer le coefficient de proportionnalité k.
2.2. A une date t = 0, on mélange dans un bécher une solution d’iodure de potassium de volume V1 = 25 mL de concentration C1 = 5,0.10-2 mol.L-1 et acidifiée (les ions oxonium seront considérés en large excès) à une solution d’eau oxygénée de volume V2 = 50 mL et de concentration inconnue C2. On verse alors rapidement un faible volume (négligeable devant V1 et V2) de ce mélange réactionnel dans une cuve qu’on introduit dans le spectrophotomètre.
2.2.1. Compléter le tableau d’avancement donné en annexe à rendre avec la copie.
2.2.2. Quelle relation littérale existe-t-il entre l’avancement x et la concentration en diiode dans le mélange réactionnel ?
2.2.3. En déduire la relation littérale entre l’absorbance A et l’avancement x de la réaction étudiée.
2.2.4. En supposant que l’iodure de potassium est le réactif en défaut, quelle valeur numérique l’avancement devrait-il prendre lorsque le système chimique atteindra son état final ? En déduire la valeur finale de l’absorbance.
3. Exploitation de la courbe représentant l’absorbance au cours du temps
Le spectrophotomètre est relié à un ordinateur qui trace la courbe représentant l’absorbance au cours du temps, le résultat est le suivant :
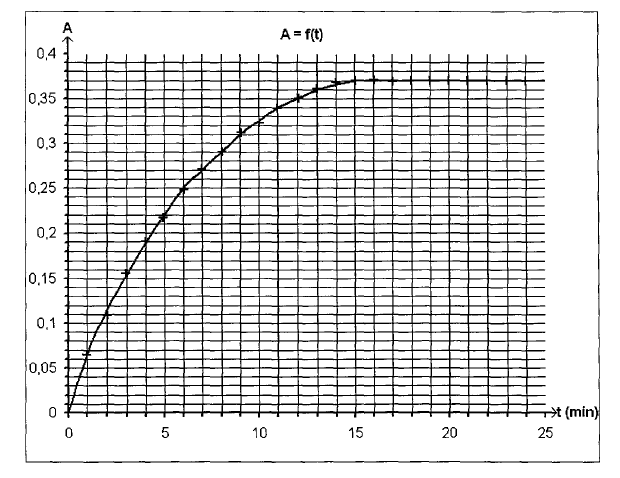
Montrer qu’elle peut se mettre sous la forme : \[\frac{ab} {cd} \cdot \frac {\text {d} A}{\text {d} t}\]
3.2. A partir de la courbe, dire comment évolue v au cours du temps. Interpréter cette évolution.
3.3. Expliquer pourquoi on peut considérer qu’au bout de 15 minutes, le système a atteint son état final.
3.4. Déterminer après l’avoir défini le temps de demi-réaction t1/2.
3.5.1. A partir de la valeur prise par l’absorbance dans l’état final, montrer que l’avancement maximal est xmax = 4,6.10–4 mol.
L’hypothèse faite en 2.2.4. est-elle correcte ?
3.5.2. Déterminer la valeur de C2, en déduire celle de CCom.
3.5.3. La réaction étudiée a-t-elle toutes les caractéristiques d’une réaction de titrage ? Conclure.
Annexe à rendre avec la copie :
2.2.1
| Équation chimique | H2O2 (aq) + 2 I- (aq) + 2 H+ (aq) = 2 H2O (l) + I 2 (aq) | |||||
|---|---|---|---|---|---|---|
| État du système | Avancement (mol) | Quantités de matière (mol) | ||||
| État initial | 0 | |||||
| État en cours de transformation | x | |||||
| État final | xmax | |||||
Exercice 3: Etude cinétique de la dismutation de l'eau oxygénée
L'eau oxygénée commerciale est une solution aqueuse de peroxyde d'hydrogène utilisée comme désinfectant pour des plaies, pour l'entretien des lentilles de contact ou comme agent de blanchiment.
Le peroxyde d'hydrogène (H2O2) intervient dans deux couples oxydant-réducteur : H2O2 (aq) / H2O(l) et O2 (g) / H2O2 (aq).
Le peroxyde d'hydrogène est capable dans certaines conditions de réagir sur lui-même c'est à
dire de se dismuter selon l'équation de réaction suivante :
Réaction 1 : 2 H2O2 (aq) = 2 H2O(l) + O2 (g)
Cette réaction est lente à température ordinaire mais sa vitesse peut être augmentée en présence d'un catalyseur.
Données :
Volume molaire des gaz dans les conditions de l'expérience : Vm 25 L.mol-1.
La partie 3 est indépendante des parties 1 et 2.
Partie 1 : Étude de la réaction de dismutation
1. Écrire les deux demi-équations d'oxydoréduction des deux couples auxquels le peroxyde d'hydrogène appartient.
Partie 2 : Détermination de la concentration initiale de la solution de peroxyde d'hydrogène
L'eau oxygénée du commerce se présente en flacons opaques afin d'éviter que la lumière favorise la transformation chimique précédente. Le flacon utilisé dans cette étude porte la mention suivante : eau oxygénée à 10 volumes. Cette indication est appelée le titre de l'eau oxygénée.
Par définition, le titre est le volume de dioxygène (exprimé en litres) libéré par un litre de solution aqueuse de peroxyde d'hydrogène suivant la réaction de dismutation dans les conditions normales de température et de pression (réaction 1). On considérera, en première approximation, que les conditions de l'expérience sont assimilables aux conditions normales.
Avant de réaliser le suivi cinétique de la réaction de dismutation, on désire vérifier l'indication donnée sur le flacon concernant le titre de l'eau oxygénée de la solution commerciale utilisée.

1. Calcul de la valeur attendue de la concentration en peroxyde d'hydrogène.
1.1 Par définition du titre de l'eau oxygénée, quel volume de dioxygène V(O2) serait libéré
par un volume V = 1,00 L de la solution commerciale au cours de la réaction de
dismutation du peroxyde d'hydrogène ?
1.2 Calculer la quantité de dioxygène formé au cours de cette transformation.
1.3 La transformation précédente étant considérée comme totale, vérifier que la concentration en peroxyde d'hydrogène notée [H2O2]th de cette solution commerciale (valeur théoriquement attendue) a pour valeur :
[H2O2]th = 8,0 X 10 -1 mol.L-1.
2. Détermination de la valeur réelle de la concentration en peroxyde d'hydrogène.
Pour vérifier la valeur de la concentration précédente, on réalise le titrage d'un volume
V0 = 10,0 mL de cette solution par une solution de permanganate de potassium acidifiée de concentration en soluté C1 = 2,0 x 10 -1 mol.L-1. Les couples oxydant-réducteur intervenant au cours du titrage sont MnO4– (aq) / Mn2+(aq) et O2 (g) / H2O2 (aq). Le volume de permanganate de potassium versé pour obtenir l'équivalence est Veq =14,6 mL.
L'équation de la réaction de titrage est la suivante :
Réaction 2 : 5 H2O2 (aq) + 2 MnO4- (aq) + 6 h3o+(aq) = 5 O2 (g) + 2 Mn2+(aq) + 14 H2O (l)
2.1 L'ion permanganate MnO4– (aq) donne une coloration violette aux solutions aqueuses qui le contiennent.
Comment l'équivalence est-elle repérée au cours du titrage ?
2.2 Quelle relation peut-on écrire entre la quantité initiale de peroxyde d'hydrogène se trouvant dans le bécher n0(H2O2) et la quantité d'ions permanganate introduits dans le bécher à l'équivalence neq(MnO4-) ?
2.3 Donner l'expression de la concentration en peroxyde d'hydrogène de la solution commerciale [H2O2]exp en fonction de C1, V0 et Veq.
2.4 Montrer que l'on a : [H2O2]exp = 7,3 ´ 10 -1L-1.
2.5 Comparer à la valeur obtenue à la question 1.3. Les erreurs de manipulation mises à part, comment peut-on expliquer l'écart de concentration obtenu ?
Partie 3 : Étude cinétique de la dismutation du peroxyde d'hydrogène
La dismutation du peroxyde d'hydrogène est une réaction lente mais qui peut être accélérée en utilisant par exemple des ions fer III (Fe3+ (aq)) présents dans une solution de chlorure de fer III, un fil de platine ou de la catalase, enzyme se trouvant dans le sang.
L'équation de la réaction associée à cette transformation est donnée dans l'introduction (réaction 1).
1. Donner la définition d'un catalyseur.
2. À quel type de catalyse correspond la catalyse réalisée par un fil de platine ?
La transformation étudiée est catalysée par les ions fer III. On mélange 10,0 mL de la solution commerciale d'eau oxygénée avec 85 mL d'eau. À l'instant t = 0 s, on introduit dans le système
5 mL d'une solution de chlorure de fer III.
Au bout d'un temps déterminé, on prélève 10,0 mL du mélange réactionnel que l'on verse dans
un bécher d'eau glacée. On titre alors le contenu du bécher par une solution de permanganate
de potassium afin de déterminer la concentration en peroxyde d'hydrogène se trouvant dans le milieu réactionnel.
On obtient les résultats suivants :
| t(min) | 0 | 5 | 10 | 20 | 30 | 35 |
|---|---|---|---|---|---|---|
| [H2O2] mol.L-1 | 7,30 x 10-2 | 5,25 x 10-2 | 4,20 x 10-2 | 2,35 x 10-2 | 1,21 x 10-2 | 0,90 x 10-2 |
3. Tracer sur la feuille de papier millimétré à remettre avec la copie l'évolution de la concentration en peroxyde d'hydrogène en fonction du temps.
Échelles :
- En abscisses 2 cm pour 5 min ;
- En ordonnées 2 cm pour 1 x 10-2 mol.L-1.

4. En utilisant le tableau d'évolution du système proposé en annexe, exprimer l'avancement de la transformation x(t) en fonction de nt(H2O2) quantité de peroxyde d'hydrogène présent à l'instant t et de n0(H2O2) quantité initiale de peroxyde d'hydrogène.
5. La vitesse volumique v de la transformation chimique est définie comme étant le rapport de la dérivée de l'avancement x(t) en fonction du temps par le volume V du système :
\[v = \frac {1} {V} \cdot \frac {\text{d} x(t)} {\text{d} t}\]
6. En s'aidant de la relation précédente et de la courbe d'évolution de la concentration en eau oxygénée en fonction du temps, indiquer comment évolue la vitesse de la transformation chimique au cours du temps. Expliquer le raisonnement.
7. Comment peut-on expliquer que la vitesse évolue de cette manière au cours de la transformation ?
8. Donner la définition du temps de demi-réaction t1/2.
10. Si la transformation chimique étudiée avait été réalisée à une température plus élevée, comment aurait évolué le temps de demi-réaction ? Justifier.
Annexes :
Question 1.2 (tableau d’évolution du système)
| Équation chimique | 2 H2O2 (aq) = 2 H2O (l) + O 2 (g) | |||||
|---|---|---|---|---|---|---|
| État du système | Avancement (mol) | Quantités de matière (mol) | ||||
| État initial | x = 0 | |||||
| État en cours de transformation | x(t) | |||||
| État final | xmax | |||||






















Si vous désirez une aide personnalisée, contactez dès maintenant l’un de nos professeurs !