Chapitres

Introduction : les ions et les cristaux ioniques

L’existence des états cristallins et amorphes ainsi que la notion de transition allotropique, présentées au premier semestre dans la partie « Transformations de la matière », vont être réinvesties et approfondies dans cette partie. Les éléments de description microscopique relatifs au « modèle du cristal parfait » sont introduits lors de l’étude des solides sur l’exemple de la maille cubique faces centrées (CFC), seule maille dont la connaissance est exigible.
Cet ensemble d’outils descriptifs sera réinvesti pour étudier d’autres structures cristallines dont la constitution sera alors fournie à l’étudiant. Aucune connaissance de mode de cristallisation pour une espèce donnée n’est exigible ; le professeur est libre de choisir les exemples de solides pertinents pour présenter les différents types de cristaux et montrer leur adéquation, plus ou moins bonne, avec le modèle utilisé.
En effet, l’objectif principal de l’étude des cristaux métalliques, covalents et ioniques est d’aborder une nouvelle fois la notion de modèle : les allers-retours entre le niveau macroscopique (solides de différentes natures) et la modélisation microscopique (cristal parfait) permettent de montrer les limites du modèle du cristal parfait et de confronter les prédictions faites avec ce modèle aux valeurs expérimentales mesurées sur le solide réel (rayons ioniques, masse volumique).
Ce chapitre constitue une occasion de revenir sur les positions relatives des éléments dans la classification périodique, en lien avec la nature des interactions assurant la cohésion des édifices présentés, ainsi que sur les interactions intermoléculaires et la notion de solubilisation pour les solides ioniques et moléculaires. À travers les contenus et les capacités exigibles, sont développées des compétences qui pourront être, par la suite, valorisées, consolidées ou réinvesties, parmi lesquelles :
- Relier la position d’un élément dans le tableau périodique et la nature des interactions des entités correspondantes dans un solide ;
- Effectuer des liens entre différents champs de connaissance ;
- Appréhender la notion de limite d’un modèle.
Histoire et présentation : tout savoir de l'ion
L'ion, différences et points communs avec l'atome
Un ion est un atome, qui à perdu ou gagné un ou plusieurs électrons.
L'atome a des caractéristiques bien particulières. Dans cette partie, nous allons les découvrir.
La masse des électrons est négligeable devant celle du noyau. On dit que la masse d'un atome est concentrée dans son noyau
Sa charge électrique se calcule facilement : elle correspond à la somme de la charge électrique + des particules du noyau et celle – des électrons. Cette somme est nulle. L'atome est donc électriquement neutre.
Les charges électriques étant les même, il y a autant d'électrons qui gravitent autour du noyau que de particules le constituant. Par exemple, l'atome de carbone a 6 électrons et 6 protons dans son noyau.
Un atome (ou groupe d'atomes) qui perd un ou plusieurs électrons devient alors une espèce chimiquement chargée appelée ion. La charge du noyau reste inchangée.
Un ion négatif est un atome (ou groupe d'atome) qui à gagné un ou plusieurs électrons. On nomme ce type d'ions anions.
Un ion positif est un atome (ou groupe d'atome) qui à perdu un ou plusieurs électrons. Ces ions se nommes cations.
Afin de trouver facilement leur charge, on ajoute en exposant la valeur de leur charge électrique. L'ion sodium se notera donc Na+.
Histoire de la découverte de l'ion
C'est Michael Faraday en 1834 qui énonce pour la première fois le nom d'ion. Au départ, pour lui, ce sont les éléments chimiques responsables de la conductivité électrique au sein des solutions.
Dans des recherches plus poussées en 1853, un physicien et chimiste allemand, Johan Wihelm Hittorf, commence à remarquer que les ions migrent plus ou moins vite vers les électrodes. Il donne alors aux ions un "nombre de transfert".
Nom Formule Ion aluminium Al3+ Ion ammonium NH4+ Ion argent Ag+ Ion baryum Ba2+ Ion calcium Ca2+ Ion carbonate CO32- Ion chlorure Cl- Ion fer (II) Fe2+ Ion fer (III) Fe3+ Ion hydrogène H+ Ion magnésium Mg2+ Ion hydrogénocarbure HCO3- Ion hydroxyde HO-
Ion iodure I- Ion manganèse (II) Mn2+ Ion nitrate NO3- Ion phosphate PO43- Ion potassium K+ Ion plomb (II) Pb2+ Ion sodium Na+ Ion sulfate SO42- Ion zinc Zn2+ Ion bromure Br-
| Nom | Formule |
|---|---|
| Ion aluminium | Al3+ |
| Ion ammonium | NH4+ |
| Ion argent | Ag+ |
| Ion baryum | Ba2+ |
| Ion calcium | Ca2+ |
| Ion carbonate | CO32- |
| Ion chlorure | Cl- |
| Ion fer (II) | Fe2+ |
| Ion fer (III) | Fe3+ |
| Ion hydrogène | H+ |
| Ion magnésium | Mg2+ |
| Ion hydrogénocarbure | HCO3- |
| Ion hydroxyde | HO- |
| Ion iodure | I- |
| Ion manganèse (II) | Mn2+ |
| Ion nitrate | NO3- |
| Ion phosphate | PO43- |
| Ion potassium | K+ |
| Ion plomb (II) | Pb2+ |
| Ion sodium | Na+ |
| Ion sulfate | SO42- |
| Ion zinc | Zn2+ |
| Ion bromure | Br- |
Le lithium (Li) perd un électron il devient l'ion de lithium (Li+). Un autre exemple, le fluor (F) gagne un électron, il devient l'ion de fluor (F-). Si un atome perd 2 électrons, imaginons que cette atome soit l'hydrogène (H), il devient l'ion d'hydrogène (H+2).
Votre professeur de physique chimie vous expliquera tout cela.
Le solide et les cristaux ioniques

Les cristaux ioniques sont constitués d'anions et de cations tenus entre eux par l'attraction électrique. Cette attraction est responsable de la structure géométrique qu'adoptent les ions pour former un cristal. Un ion positif va s'entourer d'ions négatifs et réciproquement et de la même manière que les atomes ou molécules forment les solides, les ions forment les cristaux.
Exemple :Dans un cristal de chlorure de sodium NaCl, les ions adoptent une structure cubique où un anion est entouré de 6 cations. Un cristal ionique est toujours électriquement neutre donc il y a autant de charges positives que négatives. Par conséquent, certains cristaux possèdent plus d'anions et de cations (ou inversement).
Les ions étant jointifs, la distance qui les sépare correspond à la distance entre leur centre. La cohésion du cristal est due à l'interaction coulombienne qui correspond à la force qui lie deux ions. La valeur de cette force peut paraître faible mais elle est bien plus importante par rapport au poids de l'ion. A cette échelle, c'est la force électrique qui domine. La température de fusion des solides ioniques est assez élevée (801 °C) pour le sel, ce qui veut dire que les liaisons entre ions sont très solides.
Où trouver des cours de physique chimie 4ème ?
Avant d'aller plus loin, une définition essentielle
On appelle solution électrolytique toute solution obtenue par la dissolution d'une substance appelée soluté dans un liquide que l'on appelle solvant. Le soluté peut être sous la forme de solide, de gaz ou de liquide et si l'eau constitue le solvant de la solution, on parle alors de solution aqueuse. De ce fait, une solution électrolytique correspond à une solution contenant des ions. Elle est alors conductrice tout en étant électriquement neutre.
Les propriétés du cristal ionique
Les cristaux ioniques sont constitués d'anions et de cations tenus entre eux par l'attraction électrique. Cette attraction est responsable de la structure géométrique qu'adoptent les ions pour former un cristal. Un ion positif va s'entourer d'ions négatifs et réciproquement et de la même manière que les atomes ou molécules forment les solides, les ions forment les cristaux.
Exemple : Dans un cristal de chlorure de sodium NaCl, les ions adoptent une structure cubique où un anion est entouré de 6 cations. Un cristal ionique est toujours électriquement neutre donc il y a autant de charges positives que négatives. Par conséquent, certains cristaux possèdent plus d'anions et de cations (ou inversement).
Cristaux ioniques et cohésion de la structure
Les ions étant jointifs, la distance qui les sépare correspond à la distance entre leur centre. La cohésion du cristal est due à l'interaction coulombienne qui correspond à la force qui lie deux ions. La valeur de cette force peut paraître faible mais elle est bien plus importante par rapport au poids de l'ion. A cette échelle, c'est la force électrique qui domine. La température de fusion des solides ioniques est assez élevée (801 °C) pour le sel, ce qui veut dire que les liaisons entre ions sont très solides.
Rappel : la loi de Coulomb
Coulomb, un physicien français, a établi en 1758 que le champ doit varier comme le carré inverse de la distance entre les charges à une précision de 0,02 sur l'exposant avec l'aide d'un dispositif appelé balance de Coulomb. Cette balance est constituée d'un fil de torsion en argent sur lequel est fixé des matériaux chargés. Ainsi, la loi d'attraction entre deux charges ponctuelles notées q1 et q2 , fixes dans le référentiel défini et séparées par une distance r, se définit ainsi :
- La force est dirigée selon la droite reliant les deux charges ;
- Elle est attractive si les charges sont de signes opposée et répulsive sinon ;
- Son intensité est proportionnelle aux valeurs de q1 et q2 et varie en raison inverse du carré de la distance r.
Il est alors possible de traduire ces caractéristiques en une formule exprimant la force exercée par q1 sur q2 :  Avec :
Avec :
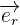 le vecteur unitaire de la droite reliant q1 et q2 qui est dirigée dans le sens 1 vers 2
le vecteur unitaire de la droite reliant q1 et q2 qui est dirigée dans le sens 1 vers 2 la permittivité diélectrique du vide
la permittivité diélectrique du vide
Ce qui peut rendre la compréhension de cette formule compliquée est la notion de force à distance. En effet, comment une charge peut savoir qu'une autre charge ponctuelle se trouve à une certaine distance d'elle et alors exercer sur force sur cette charge en fonction de la distance qui les sépare. Dans ce cas, tout comme pour un champ gravitationnel, il peut être utile de séparer dans la loi de force ce qui dépend de la charge subissant la force et donc d'obtenir la relation suivante : 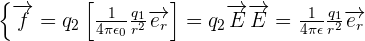 Avec :
Avec :
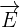 un champ électrique électrostatique créé à partie de la charge q1 au point où se trouve la seconde charge q2
un champ électrique électrostatique créé à partie de la charge q1 au point où se trouve la seconde charge q2
Ainsi, avec cette relation, il est plus aisé d'interpréter l’existence d'une force à distance. En effet, la charge considérée comme "source", c'est-à-dire q1, crée en tout point de l'espace un champ électrique dont la forme est donnée par la relation exprimée ci-dessus, et une charge quelconque considérée comme "test" subira l'effet de ce champ sous la forme d'une force égale au produit de cette charge par le champ électrostatique. Dans ce cas, ce champ électrostatique apparaîtra comme la force entre deux particules ponctuelles fixes par unité de charge.
Les ions interviennent dans les électrolyses
Les débuts de l'électrolyse
C'est en 1800 que la toute première électrolyse a été réalisée par deux chimistes originaires de Londres, William Nicholson et Sir Anthony Carlisle. Ils réalisent une électrolyse de l'eau. L'électrolyse met en jeu deux couples rédox. Il les fait réagir dans le sens contraire de la réaction naturelle au moyen d'un courant électrique qui apporte l'énergie nécessaire à la réaction. Un électrolyseur est un dispositif consistant en une récipient contenant une solution ionique dans laquelle plongent deux électrodes.
Description de l'électrolyse

Une électrolyse est une opération chimique dont le but est de décomposer différentes matières. Par exemple, lorsqu'une solution contient une matière, on va y ajouter un solvant afin que ses ions soient décomposables. On plonge alors ce mélange dans un bain auquel sont intégrés une anode et une cathode, faisant alors passer un courant dans le bain. Pour être bref, afin d'obtenir une électrolyse, il faut imposer une tension électrique entre deux électrodes plongées dans une solution dite électrolytique. Cela va alors provoquer un transfert d'électron d'un oxydant vers un réducteur. L'électrolyse permet alors de provoquer des transformations dites forcées.
L'électron est donc l'un des composants de l'atome au même titre que les neutrons et protons. C'est une particule élémentaire que l'on note e et dont la charge élémentaire est de signe négatif. Ils s'organisent autour du noyau de l'atome dans ce que l'on appelle un nuage électronique. Les électrons et leurs propriétés ont aidé à la compréhension d'une multitude de phénomènes physiques, notamment en termes de conductivité. Un oxydant, également appelé agent d'oxydation, correspond à un ion, un corps simple ou un composé qui, lors d'une réaction d'oxydoréduction, reçoit un ou plusieurs électrons d'une autre espèce chimique. Un réducteur, également appelé agent de réduction, correspond à un ion, un corps simple ou un composé qui, lors d'une réaction d'oxydoréduction, cède un ou plusieurs électrons à une autre espèce chimique.
Ce procédé est régulièrement utilisé afin de purifier les métaux tels que le cuivre ou encore pour protéger le fer de la corrosion par électrozingage. Vous pouvez également utiliser cette technique pour embellir votre service de couvert en les argentant ou pour récupérer différentes substances telles que de l'aluminium ou du dichlore. L'électrozingage repose sur le dépôt d'électrolyte de zinc sur le fer afin de le protéger grâce à l'obtention d'un revêtement protecteur. On dit alors du fer qu'il est électrozingué. Dans l'industrie, afin d'affiner du cuivre brut, on utilise le cuivre en tant qu'anode dans un bain de sulfate de cuivre afin de procéder à une électrolyse. Ainsi, du cuivre pur jusqu'à un pourcentage de 99,95% se fixera sur la cathode alors que les impuretés resteront dans le bain de sulfate de cuivre. On utilise aussi les bains électrolytiques pour le plaquage des métaux. En effet, ces procédés, connus sous les noms de dorure, argenture, nickelage, chromage, cadmiage, cuivrage, galvanoplastie ou autres consistent au recouvrement de certains objets par une couche de métal précieux comme cuivre ou de l'or par exemple. Le fonctionnement est simple, on plonge l'objet dans un bain avec deux électrodes : une anode et une cathode. La cathode est connectée sur la pièce qui va recevoir le placage, l'anode est quant à elle reliée à du cuivre. En envoyant du courant, le cuivre va se déplacer sur l'objet. On peut réguler le placage avec différents facteurs comme la concentration ou la température qui rendront le placage plus rapide ou plus épais.
Rappel sur les réactions d'oxydo-réduction
Une réaction d'oxydoréduction, également appelée réaction redox, correspond à une réaction chimique au cours de laquelle a lieu un transfert d'électron. C'est-à-dire une réaction durant laquelle une espèce chimique dite oxydant reçoit un ou plusieurs électrons d'une autre espèce chimique dite réducteur. Un oxydant, correspond à un ion, un corps simple ou un composé qui, lors d'une réaction d'oxydoréduction, reçoit un ou plusieurs électrons d'une autre espèce chimique. Lavoisier mettra en évidence en 1772, suite à ses manipulations du mercure, le rôle du dioxygène dans certaines réactions d'oxydoréduction. D'où le nom oxydation qui signifie "combinaison avec l'oxygène". Un réducteur, également appelé agent de réduction, correspond à un ion, un corps simple ou un composé qui, lors d'une réaction d'oxydoréduction, cède un ou plusieurs électrons à une autre espèce chimique. Réduction quant à lui signifie "l'extraction d'un métal de son oxyde", une définition connue en métallurgie.























Si vous désirez une aide personnalisée, contactez dès maintenant l’un de nos professeurs !
merci beaucoup
il manque quelque formule
Ion Hydronium H3O+
Ion Hydrogénocarbonate HCO3-
Merci même s’il y avait quelques erreurs il y avait des ions que je ne connaissais pas
c’est quoi l’ion Cu? Svp merci
j’espere que ses quelques vont m’aider
Merci mais quelques erreurs quand même :
Ion cuivre : Cu2+
Ion Fer II : Fe2+
Ion Fer III : Fe3+
Ion bromure : Br-
Pour le cuivre a deux ions
Cuivre I cu+ et Cuivre II Cu2+
Merci