Chapitres

Rappels sur le pH
Le pH, ou encore potentiel hydrogène, correspond à une mesure de l'activité chimique de ce qu'on appelle les hydrons dans une solution. Mais vous les connaissez plus certainement sous le nom de protons ou encore ions hydrogènes. De façon plus particulière, ces protons, dans une solution aqueuse, se présent sous la forme de l'ion hydronium qui représente le plus simple des ions oxonium. Le pH est, le plus souvent, utilisé afin de mesurer l'acidité ou encore la basicité du solution. On peut alors la déterminer avec l'échelle suivant dans le cas d'un milieu aqueux à 25°C :
- Une solution de pH égal à 7 est considérée comme étant neutre ;
- Une solution de pH inférieur à 7 est considérée comme étant acide. De ce fait, plus son pH diminue, plus elle est acide ;
- Une solution de pH supérieur à 7 est considérée comme étant basique. De ce fait, plus son pH augmente, plus elle est basique.

Mais la définition que nous connaissons aujourd'hui du pH, définition de Sorensen, n'a été officiellement reconnue qu'à partir du milieu du XXe siècle par l'UICPA.
L’UICPA, l’Union Internationale de Chimie Pure et Appliquée est une organisation non gouvernementale ayant son siège à Zurich, en Suisse. Créée en 1919, elle s’intéresse au progrès de la chimie, de la chimie physique et de la biochimie. Ses membres sont les différentes sociétés nationales de chimie et elle est membre du Conseil International pour la Science. L’UICPA est une autorité reconnue dans le développement des règles à adopter pour la nomenclature, les symboles et autres terminologie des éléments chimiques et leurs dérivé via son Comité Interdivisionnel de la Nomenclature et des Symboles. Ce comité fixe la nomenclature de l’UICPA.
Cette définition est donc celle que nous retrouvons dans les manuels scolaire et s'énonce ainsi :  Avec aH, également noté aH+ ou [H+], qui correspond à l'activité des ions hydrogène H+. aH correspond donc à une grandeur sans dimension tout comme le pH. Néanmoins, cette définition ne nous permet pas d'obtenir des mesures directes du pH ni même des calculs. En effet, le pH dépend uniquement de l'activité des ions hydrogènes. De ce fait, le pH dépend de plusieurs autres facteurs découlant de cette activité. On peut par exemple parler de l'influence du solvant ou encore de la température. Il reste cependant possible d'obtenir des valeurs approchées du pH en utilisant ce calcul. Pour cela, il est nécessaire de faire appel à des définitions de l'activité. Cette définition formelle ne permet pas des mesures directes de pH, ni même des calculs. Le fait que le pH dépende de l’activité des ions hydrogène induit que le pH dépend de plusieurs autres facteurs, tels que l’influence du solvant. Toutefois, il est possible d’obtenir des valeurs approchées de pH par le calcul, à l’aide de définitions plus ou moins exactes de l’activité.
Avec aH, également noté aH+ ou [H+], qui correspond à l'activité des ions hydrogène H+. aH correspond donc à une grandeur sans dimension tout comme le pH. Néanmoins, cette définition ne nous permet pas d'obtenir des mesures directes du pH ni même des calculs. En effet, le pH dépend uniquement de l'activité des ions hydrogènes. De ce fait, le pH dépend de plusieurs autres facteurs découlant de cette activité. On peut par exemple parler de l'influence du solvant ou encore de la température. Il reste cependant possible d'obtenir des valeurs approchées du pH en utilisant ce calcul. Pour cela, il est nécessaire de faire appel à des définitions de l'activité. Cette définition formelle ne permet pas des mesures directes de pH, ni même des calculs. Le fait que le pH dépende de l’activité des ions hydrogène induit que le pH dépend de plusieurs autres facteurs, tels que l’influence du solvant. Toutefois, il est possible d’obtenir des valeurs approchées de pH par le calcul, à l’aide de définitions plus ou moins exactes de l’activité.
Remarque
le p de pH représente la fonction "- log" donc ici - log (H). Donc si on parle de pOH ou de pKa, cela signifie que l'on parle de - log (OH) et de - log (Ka).
Nouvelle définition du pH
Aujourd'hui, une autre définition du pH a été donné par l'UICPA. Cette définition, déterminée grâce à une méthode électrochimique expérimentale, consiste à utiliser la relation de Nernst dans une cellule électrochimique définie comme qui suit : Électrode de référence | Solution de KCl concentré | Solution X | H2 | Pt (électrode à hydrogène) Ainsi, via des mesures de ce qu'on appelle force électromotrice, également notée fem ou f.e.m., de la cellule avec une solution de référence notée S, on peut obtenir la relation suivante :  Avec :
Avec :
- pH(X) représentant le pH de la solution inconnue ;
- pH(S) représentant le pH tabulé de la solution de référence S ;
- EX représentant la f.e.m. de la cellule avec la solution inconnue X ;
- ES représentant la f.e.m. de la cellule avec la solution de référence S à la place de la solution X ;
- F = 96 485 C mol−1 représentant la constante de Faraday ;
- R = 8,314 472 J mol−1 représentant la constante universelle des gaz parfaits ;
- Et T représentant la température absolue, en kelvins.
La mesure de pH
La mesure du pH peut se faire à l'aide d'outils comme :
- Le papier pH qui indique la valeur du pH à une unité près ;
- Ou le pHmètre qui indique, quant à lui, une valeur du pH à 0.1 unité près.
A noter que le pH est plus généralement mesuré grâce au pH-mètre, celui-ci reposant sur l'électrochimie et restant plus précis que le papier pH qui n'est qu'un indicateur. Le pH-mètre est appareil composé d'une électrode combinée spéciale, également appelée électrode de verre, ou encore de deux électrodes séparées. De façon générale, l'électrode de référence utilisée dans les pH-mètre correspond à une électrode au calomel saturée, également notée ECS. Mais le pH peut également être trouvé par calcul : En effet, d'après la loi de Nernst, 

Avec :
- X représentant la solution dont on cherche à déterminer le pH ;
- S représentant la solution de référence ;
- R représentant la constante de gaz parfaits ;
- T représentant la température ;
- F représentant la constante de Faraday.
Il peut être intéressant de noter que, à une température de 298 K, on obtient : 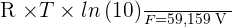
Autoprotolyse de l'eau
1.1. pH de l'eau pure
A 25°C : pH = 7.0 -> [H3O+] = 10-pH = 10-7mol/L Ces ions proviennent de la réaction entre l'eau et l'eau. Réaction qu'on appelle autoprotolyse. H2O(l) + H2O(l) + H3O+(aq) + HO- (aq) Cette réaction est limitée. La concentration [HO-] est de 10-7 mol/L
1.2. Produit ionique de l'eau
Le produit ionique de l'eau correspond au quotient de réaction à l'équilibre Qréq de la réaction d'autoprotolyse de l'eau. Qréq= Ke = [H3O+] [HO-] C'est une constante. Ke = 10-14 à 25°C Remarque : Dans n'importe quelle solution, cette relation est toujours vérifiée. Remarque : On définit en chimie le pK, grandeur liée au K par la relation pK = - log (K)
Constante d'acidité
2.1. Définition
Chaque acide (donc chaque base conjuguée) peut être considéré(e) par sa constante d'acidité, notée Ka. Elle correspond à la constante d'équilibre de la réaction de cet acide dans l'eau.
2.2. Expression du Ka d'un acide
AH (aq) + H2O(l) = A- (aq) + H3O+(aq)  Remarque : Plus le pKa d'un acide est grand, plus cet acide est dissocié dans l'eau, plus il réagit avec l'eau, plus son pKa est petit. Remarque : Plus l'acide d'un couple va être fort, plus sa base conjuguée est faible.
Remarque : Plus le pKa d'un acide est grand, plus cet acide est dissocié dans l'eau, plus il réagit avec l'eau, plus son pKa est petit. Remarque : Plus l'acide d'un couple va être fort, plus sa base conjuguée est faible.
Constante d'équilibre d'une réaction d'une réaction acido-basique

3.1. Equation de réaction
A1H + A2- = A1- + A2H Il va y avoir un échange protonique entre l'acide et la base. Toute réaction acido-basique est caractérisée par sa constante d'équilibre.
3.2. Expression de la constante d'équilibre.
Remarque : Une réaction est caractérisée totale si la constante d'équilibre est supérieure ou égale à 104.
Diagramme de prédominance
Lors des équilibres chimiques, il y a coexistence en solution de l'espèce acide AH et de l'espèce base A- conjuguée.
4.1. Relation entre pH et pKa

4.2. Construction du diagramme

4.3. Indicateur coloré
Il est constitué par un couple acide/base dont l'espèce acide et base conjuguée ont des teintes différentes. On le note Hind/ind-. il est caractérisé par son pKa. Exemple : Bleu de Bromothymol (BBT) 
4.4. Diagramme de distribution
C'est une courbe sur laquelle apparaît le pourcentage de l'espèce acide (ou basique) en fonction du pH. 
Les réactions acido-basiques
Acide et base selon Brönsted
Un acide est une espèce chimique capable de céder un proton H+.
Une base est une espèce chimique capable de capter un proton H+.
On obtient donc une réaction acido-basique :  Dans cet exemple, on peut alors parler de :
Dans cet exemple, on peut alors parler de :
- Couple AH/A-
- Couple BH+/B
Il y a un transfert d'un proton H+ entre l'acide d'un couple et la base d'un autre couple. A chaque acide est associé une base qui est dite base conjuguée (réciproquement). Les deux forment un couple Acide/Base.
Quelques attaques à l'acide
Protocole expérimental
N'oubliez pas de boucher le tube avec votre doigt de façon à ne pas laisser s'échapper le gaz produit.
Observations
- Un dégagement gazeux.
- La solution verdit et le Fer est attaqué, il disparaît petit à petit.
Interprétation
Une réaction chimique à lieu.
Quels sont les produits formés ?
Le dégagement gazeux
- Approcher à l'extrémité du tube une allumette enflammée.
- Une légère détonation se produit.
- Ce test permet de mettre en évidence le gaz dihydrogène de formule H2.
Les ions présents dans la solution.
Prélever dans deux tubes à essais, la solution obtenue à la fin de la réaction chimique.
- Ajouter dans l'un des tubes quelques goutte d'une solution d'hydroxyde de sodium.
- Ajouter dans l'autre tube quelques gouttes d'une solution de nitrate d'argent.
Complétez le tableau suivant :
| Tests | Observations | Résultats |
|---|---|---|
| Test à la soude | Précipité vert | Présence d'ions Fe2+ |
| Test au nitrate d'argent | Précipité blanc qui noircit à la lumière | Présence d'ions Cl- |
- Les produits de la réaction sont :
- Le Dihydrogène.
- La solution de Chlorure de Fer II
Bilan de la réaction et équation-Bilan
Le Bilan de la réaction chimique s'écrit :
Fer + Acide Chlorhydrique → Dihydrogène + Solution de Chlorure de Fer II
L'équation Bilan s'écrit :
2 (H+ + Cl-) Fe → H2 + ( Fe2+ + 2 Cl-)
Remarque : Les ions Chlorure sont des ions spectateur. Ils assistent à la réaction sans y participer ( D'où l'équation bilan simplifié ) qui consiste à les enlever.
L'équation bilan simplifié s'écrit :
Fe + 2 H+ → H2 + Fe2+
Protocole expérimental

Remplacer la poudre de Fer par de la poudre de Zinc. Ensuite recommencez le TP comme précédemment.
Observations
- Un dégagement gazeux.
- La solution devient grisâtre, le Zinc est attaqué. Il disparaît petit à petit.
Interprétation
Une réaction chimique à lieu.
Quels sont les produits formés.
Le dégagement gazeux
Approcher à l'extrémité du tube une allumette enflammée : Une légère détonation se produit. Ce test permet de mettre en évidence le gaz dihydrogène. De formule : H2.
Les ions présent dans la solution
Prélever dans deux tubes à essais, la solution obtenue à la fin de la réaction chimique.
- Ajouter dans l'un des tubes quelques goutte d'une solution d'hydroxyde de sodium.
- Ajouter dans l'autre tube quelques gouttes d'une solution de nitrate d'argent.
Complétez le tableau suivant :
| Tests | Observations | Résultats |
|---|---|---|
| Test à la soude | Précipité blanc | Présence d'ions Zn2+ |
| Test au nitrate d'argent | Précipité blanc qui noircit à la lumière | Présence d'ions Cl- |
- Les produits de la réaction sont
- Le Dihydrogène.
- La solution de Chlorure de Zinc.
Bilan de la réaction et équation bilan.
Le bilan de la réaction chimique s'écrit :
Zinc + Acide Chlorhydrique → Dihydrogène + Solution de Chlorure de Zinc.
L'équation Bilan s'écrit :
2 ( H+ + Cl-) + Zn → H2 + ( Zn2+ + 2 Cl-)
Remarque : Les ions Chlorure sont des ions spectateur. Ils assistent à la réaction sans y participer ( D'où l'équation bilan simplifié ) qui consiste à les enlever.
L'équation bilan simplifié s'écrit :
2 H+ + Zn → H2 + Zn2+











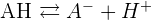
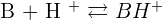












Si vous désirez une aide personnalisée, contactez dès maintenant l’un de nos professeurs !