Chapitres
Les molécules chimiques possèdent toutes une formule qui permet de les reconnaître, les identifier et les distinguer des autres molécules. Lesquelles sont à retenir en priorité ?
👍 Découvrez-le dans notre article

En résumé : dix formules à retenir 🔟
💧 Il y a de nombreuses molécules importantes à retenir en chimie, en fonction de votre domaine d'intérêt ou d'étude.
Voici quelques-unes des molécules les plus fondamentales et couramment rencontrées.
- Eau (H2O) : L'eau est essentielle à la vie et est un solvant universel. Elle est composée de deux atomes d'hydrogène et d'un atome d'oxygène.
- Dioxyde de carbone (CO2) : Le dioxyde de carbone est un gaz présent dans l'atmosphère et joue un rôle majeur dans le cycle du carbone.
- Méthane (CH4) : Le méthane est un gaz à effet de serre et un combustible fossile.
- Oxygène moléculaire (O2) : L'oxygène est essentiel à la respiration des organismes aérobies.
- Azote moléculaire (N2) : L'azote est l'élément le plus abondant dans l'atmosphère et est un élément clé des protéines et de l'ADN.
- Éthane (C2H6) : L'éthane est un hydrocarbure présent dans le gaz naturel.
- Éthanol (C2H5OH) : L'éthanol est l'alcool couramment trouvé dans les boissons alcoolisées.
- Acide sulfurique (H2SO4) : L'acide sulfurique est un acide fort largement utilisé en chimie et dans l'industrie.
- Chlorure de sodium (NaCl) : Le chlorure de sodium est communément appelé sel de table et est essentiel à la nutrition.
- Ammoniac (NH3) : L'ammoniac est un composé azoté couramment utilisé dans l'industrie chimique.
Grâce à ces formules chimiques, vous pourrez facilement construire d'autres formules. En voici un tableau détaillé pour votre information :
| Molécule | Formule |
|---|---|
| Dihydrogène | H2 (g) |
| Dioxygène | O2 (g) |
| Eau | H2O (L) |
| Peroxyde d'hydrogène (eau oxygénée) | H2O2 (L) |
| Dioxyde de carbone | CO2 (g) |
| Acide carbonique | CO2 (aq)-H2O |
| Monoxyde de carbone | CO (g) |
| Diazote | N2 (g) |
| Dioxyde d'azote | NO2 (g) |
| Dichlore | Cl2 (g) |
| Dibrome | Br2 (L) |
| Diiode | I2 (s) |
| Méthane | CH4 (g) |
| Ammoniac | NH3 (g) |
| Ammoniaque | NH3 (aq) |
| Glucose | C6H12O6 (s) |
| Saccharose | C12H22O11 (s) |
| Acide éthanoïque (acétique) | CH3-COOH (L) |
| Benzène | C6H6 (L) |
| Acide benzoïque | C6H5-COOH (s) |
| Glycérol | CH2OH-CHOH-CH2OH |
Rôle et fonctions des molécules 🤓

⚛️ La molécule est la structure de toute matière. Elle est définie par l'UICPA. Une molécule est "une entité électriquement neutre comprenant plus d'un atome". Cet assemblage contient toujours au moins deux atomes, identiques ou différents. Ces derniers sont liés par différentes forces physiques que l'on appelle liaisons. Là aussi plusieurs types existent : on retrouvera par exemple les liaisons covalentes, les liaison hydrogènes ou encore les forces de van der Waals, dont nous reparlerons plus tard dans cet article.
📚 Le nom de molécule provient du latin “molecula” qui signifie masse
L’UICPA, l’Union Internationale de Chimie Pure et Appliquée est une organisation non gouvernementale ayant son siège à Zurich, en Suisse. Créée en 1919, elle s’intéresse au progrès de la chimie, de la chimie physique et de la biochimie. Ses membres sont les différentes sociétés nationales de chimie et elle est membre du Conseil International pour la Science.
L’UICPA est une autorité reconnue dans le développement des règles à adopter pour la nomenclature, les symboles et autres terminologie des éléments chimiques et leurs dérivé via son Comité Interdivisionnel de la Nomenclature et des Symboles. Ce comité fixe la nomenclature de l’UICPA.
Histoire de la molécule
👨🔬 La molécule a été évoquée et présentée pour la première fois en 1811 par Avogadro, chimiste et physicien italien. Cette vision vient bouleverser celle de l’Antiquité qui pensait que toute matière était constituée de feu, de terre, d’eau ou d’air : les quatre éléments. De même, les concepts d’atome et de molécule restaient abstraits.
Avogadro énoncera alors une phrase célèbre : “ La plus petite particule constitutive d’un gaz n’est pas nécessairement un atome unique, mais une combinaison d’un certain nombre de ces atomes unis par des forces attractives pour former une molécule unique”.
🥼 Au début des années 1900, Gilbert Newton Lewis, physicien et chimiste américain, commença à représenter par des points les électrons autour des atomes lors de ses cours de chimie à Harvard. En effet, ce dernier avait remarqué que les électrons avaient un rôle dans la stabilité de la molécule.
Dans la continuité de ses recherches, Lewis proposa aussi la règle de l’octet : les ions et atomes remplissent une couche d’électrons dits de valence. Quand cette couche se compose 8 électrons, la stabilité de la molécule est supérieure.
Il crée alors des structures de représentation de la molécule, des liaisons également :
Liaison covalente
Liaison ionique
Double liaison
👉 C’est comme cela que naît la représentation de Lewis de la molécule, introduite par l’article L’atome et la molécule publié par Lewis en 1916
Composition et structure de la molécule 🧫
Les compositions des molécules dépendent de chacune d'entres elles. On peut déduire la composition de ces dernières en fonction de leur formule chimique.
Par exemple, CO2 est une molécule de dioxyde de carbone. Cette dernière est donc composée d'un atome de carbone et de deux atomes d'oxygènes.

État de la molécule
La molécule existe dans plusieurs états, qui déterminent également sa structure.
Solide
Liquide
Gazeux
À ces trois états vient s’ajouter le plasma. Il faut savoir :
- L'état solide est l'état le plus "serré" de la matière. Dans ce cas, toutes les molécules sont collées les unes au autres, c'est ce qui donne à l'élément sa solidité
- L'état liquide est un intermédiaire entre l'état solide et l'état gazeux. La matière y est malléable et coule
- L'état gazeux est l'état dans lequel la matière est la plus dissipée. En effet, un gaz occupe toute la place qu'on lui offre, ce qui signifie qu'il peut s'étendre
- Le plasma apparaît dans des conditions de température et de pression extrêmes. Dans ces conditions, même la structure atomique est totalement désorganisée. Ainsi, dans l’état de plasma, les constituants de l'atome se séparent. Les noyaux et les électrons se déplacent indépendamment et forment un mélange globalement neutre. Cet état de neutralité en fait l’état le plus important de l’Univers : le plasma représente près de 90% de la matière visible
🙋♂️ À chaque état correspond une structure particulière :
- À l'état solide, les molécules s'empilent, le plus souvent de manière régulière
- À l'état liquide, l'espacement entre les molécules est petit, ce qui fait qu'elles sont peu agitées
- En revanche, à l'état gazeux, les molécules sont espacées et leur agitation est maximale. C'est pour cela que l'on dit qu'un gaz prend toute la place qu'on lui offre. Ce sont les forces d'interaction entre les molécules qui régissent leur agencement. Celui-ci est défini par les forces de Van Der Waals.
Forces de Van Der Waals
🧔♂️ Nommées ainsi en l'honneur de Johannes Diderik van der Waals, un physicien néerlandais du XIX ème siècle, ces forces peuvent se décrire comme les interactions électroniques entres les atomes ou molécules, qui les lient ensemble. Johannes Diderik van der Waals fut le premier à les prendre en compte dans ses calculs en 1873. Cela lui valut de recevoir en 1910 le prix Nobel de physique.
Ce phénomène s'explique par la répartition des charges au sein d'une molécule ou au sein des couples d'atomes. Pour plus de détails, il faut néanmoins se plonger dans la physique quantique pour en comprendre les principes les plus poussés. On peut leur trouver trois origines :
- L'interaction électrostatique attractive entre deux multipôles induits, il s'agira dans ce cas des forces de London ;
- L'interaction attractive entre un multipôle permanent et un multipôle induit et il s'agira des forces de Debye ;
- L'interaction électrostatique attractive ou répulsive entre deux multipôles permanents selon leurs orientations, il s'agit alors des forces de Keesom.
Les exemples les plus flagrants des effets des forces de Van Der Waals sont les absorptions par capillarité ainsi que les systèmes d'accroche des pattes de gecko qui peuvent coller aux murs.
Les changements d’états
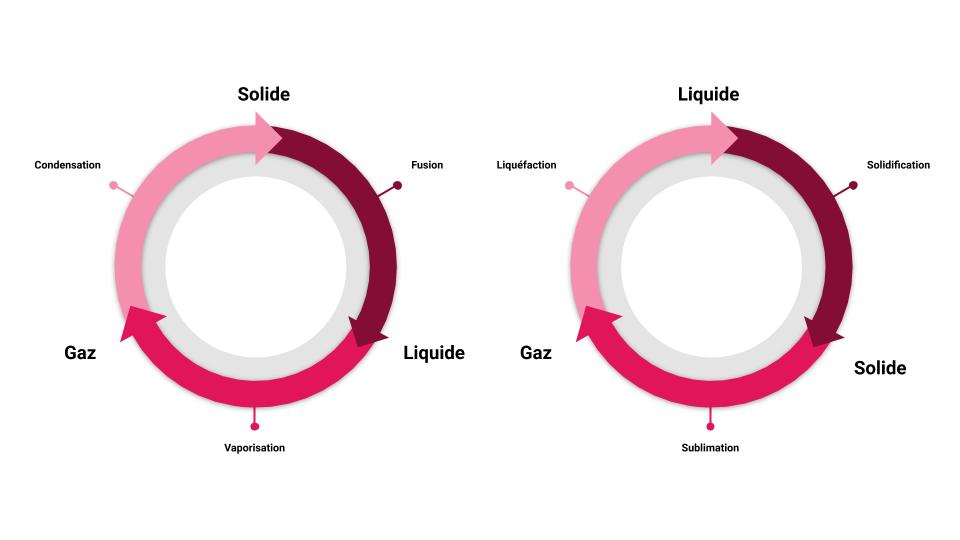
La condensation
💨 La condensation solide est le phénomène qui se produit lorsque de l'eau sous forme de vapeur vient toucher une surface très froide. Par exemple, si l'on souffle sur une vitre gelée, la vapeur d'eau contenue dans notre respiration gèlera instantanément en se transformant en eau solide.
La vaporisation
💦 La vaporisation est le passage de l'état liquide à l'état gazeux. Même si le nom est proche, cela n'a aucun rapport avec le fait de projeter de l'eau avec un vaporisateur. La vaporisation a lieu lorsqu'on laisse évaporer de l'eau au soleil ou quand on la porte à ébullition.
La solidification
🧊 La solidification est le phénomène durant lequel l'eau liquide devient solide. Cela se produit quand elle gèle, on parle alors de congélation. L'eau se met à se solidifier une fois qu'elle descend en dessous de 0° C. L'eau peut aussi se solidifier en cas de cristallisation ou d'augmentation de la pression.
La fusion
🔥 La fusion intervient lorsque de la glace fond. Par exemple, un glaçon dans un verre d'eau. Il s'agit donc du passage de l'état solide à l'état liquide.
La sublimation
⛴️ La sublimation intervient quand l'eau passe directement de l'état solide à l'état gazeux. Cela fait que la glace devient vapeur sans même passer par les étapes habituelles de fusion et de vaporisation. Cela peut arriver lorsque de l'eau très chaude entre en contact avec de l'air très froid. Elle part alors en fumée blanche (de la vapeur d'eau).
La liquéfaction
🏝️ Il s'agit de la transformation inverse de la vaporisation. Elle intervient quand de la vapeur d'eau se transforme en eau liquide. La liquéfaction a lieu soit par compression : la pression qui augmente rends l'eau gazeuse liquide ou par refroidissement et dans ce cas le gaz refroidit pour devenir liquide, c'est la condensation.
Les liaisons et stabilité
⚡️ Les molécules ont normalement une charge électrique neutre. En effet, leurs atomes sont liés par des liaisons covalentes la plupart du temps. Lorsqu'une molécule n'est pas neutre, il s'agit d'un ion.
Une liaison covalente est une liaison chimique entre deux atomes qui vont se partager deux électrons. Il peut d'agir d'un électron chacun ou d'un atome qui va partager ses deux électrons. Si une seule paire d'électrons est partagée, on parle alors d'un doublet liant. Si il y a deux pares d'électrons il s'agira d'une liaison double et s'il y a trois paires d'électrons il s'agira d'une liaison triple.
Quelques applications fréquentes 👨🏫

Les molécules et la pomme
👌 Les formules chimiques sont essentielles pour comprendre les composants et les réactions qui se produisent dans les aliments, y compris la pomme. Une pomme est principalement composée :
- D'eau (H2O)
- De glucides (comme le saccharose, C12H22O11)
- De composés organiques tels que les acides malique (C4H6O5) et citrique (C6H8O7)
- De divers nutriments, dont des vitamines (comme la vitamine C, acide ascorbique, C6H8O6)
🍎 Lorsque vous coupez une pomme et la laissez à l'air libre, le processus de brunissement enzymatique se produit. Cela résulte de l'oxydation de composés phénoliques dans la pomme, comme l'acide chlorogénique, en présence d'oxygène de l'air. L'équation chimique illustrant cela serait complexe, mais elle montre comment les composés chimiques interagissent pour provoquer le brunissement.
👉 En outre, la formule chimique de l'amidon, qui est également présent dans la pomme, est (C6H10O5)n. Les enzymes présentes dans la pomme décomposent l'amidon en glucose, ce qui est essentiel pour la production d'énergie dans les cellules.
Ainsi, les formules chimiques nous aident à comprendre la composition, les réactions et les transformations chimiques qui se produisent dans les aliments que nous consommons, comme la pomme.























Si vous désirez une aide personnalisée, contactez dès maintenant l’un de nos professeurs !
il Ya pas beaucoup des informations
Une structure de molécule, contenant les différents types de chaînes
Je cherche 20 composé chimique de la base et leurs noms
Bonjour, nous serions ravis de vous aider ! Avez-vous essayé de contacter l’un de nos professeurs pour recevoir une aide personnalisée ? Rendez-vous sur la plateforme de Superprof, sélectionnez la rubrique “Découvrir nos Superprofs” en indiquant la matière désirée. Vous trouverez de nombreux professeurs près de chez vous. Excellente journée ! 🙂
Pb,He,Ne,P leur définition
Salut comment allez vous
Pb=plomb, He =hélium, Ne =Néon et p=phosphore
j ai aimé