Chapitres
- 01. Les ions, présentation
- 02. Les anions
- 03. Les cations
- 04. Quelques exercices

Les ions, présentation
L'atome : de ses débuts aux connaissances actuelles
Vous connaissez sûrement déjà les atomes, ces éléments qui composent les molécules. Nous allons cependant revenir sur leur définition et leur fonctionnement.
En 400 av JC, un philosophe grecque nommée Démocrite est le premier homme à penser que la matière est constitué de minuscules particules tellement petite que l'on ne peut les diviser d'où leur nom de atomos qui signifie indivisible en grec.
La première approche des électrons date de l'époque de la Grèce Antique. Ceux-ci avaient pris conscience qu'une certaine oléorésine, l'ambre était capable d'attirer des objets si elle était frottée avec de la fourrure. Sans le savoir, ils venait de découvrir l'électricité statique. Il s'agit du deuxième phénomène électrique dont l'Homme a pris conscience, juste après la foudre.
En 1269, un ingénieur militaire qui servait auprès du prince Charles Premier de Sicile, se mit à étudier le phénomène d'attirance entre des petits objets après qu'ils aient été frottés.

La découvert de l'atome est imputable à Ernest Rutherford. Durant le début des années 1910, il s'est attelé à comprendre la composition de l'atome. Il a alors déterminé que l'atome était constitué d'un noyau qui concentrait toute la charge positive et aussi presque toute la masse de l'atome. Ce noyau est entouré d'un nuage électronique composé d'électrons.
L'un de ses collègues de laboratoire, Niels Bohr, a quant à lui démontré que les états de l'électrons dépendaient de l'énergie déterminée par le nombre n de l'atome. C'est à lui qu'on doit la compréhension de l'émission d'un photon lors d'un passage à un état inférieur.
La charge électrique de l'atome est la somme de la charge électrique + des particules du noyau et celle – des électrons.
Cette somme est nulle : On dit que l'atome est électriquement neutre.
Les charges électriques étant les même, il y a autant d'électrons qui gravitent autour du noyau que de particules le constituant.
En ce qui concerne sa masse, seule celle du noyau est considérée. Pour cause, celle des électrons est presque nulle. On dit que la masse du noyau est concentrée dans son noyau.
Pour finir, la taille d'un atome est très petite. Le diamètre de l'atome vaut en moyenne 10-1 nm. Le diamètre du noyau vaut en moyenne 10-6 nm. Le noyau est 100 000 fois plus petit que l'atome. Entre les électrons et le noyau, il n'y a que du vide. On parle de la structure lacunaire de l'atome.
Le noyau de l'atome
Le noyau d'un atome se compose d'éléments que l'on appelle les nucléons. Ce sont eux qui définissent le nombre de masse d'un atome.
Le nombre de masse d’un atome est le nombre de nucléons qu’il contient. Il s’agit donc de la somme du nombre de protons et du nombre de protons qui constituent le noyau de l’atome
Dans ces nucléons se trouvent des protons dont la charge est positive et des neutrons à charge neutre. Ces deux composants sont très fortement liés entre eux.
Le rayon d'un nucléon est d'environ 10-15 m alors que l'atome tout entier a un diamètre avoisinant les 10-10 m.
Pour que le noyau et les électrons restent stables entre eux. Ils sont donc liés par une énergie de liaison. Si ils ne sont pas bien liés entre eux, les atomes deviennent instables et se transforment. Ils sont donc radioactifs.
L'ion, un atome chargé
Un atome (ou groupe d'atomes) qui perd un ou plusieurs électrons devient une espèce chimiquement chargée appelée ion. La charge du noyau reste inchangée.
Un ion négatif est un atome (ou groupe d'atome) qui à gagné un ou plusieurs électrons.
Un ion positif est un atome (ou groupe d'atome) qui à perdu un ou plusieurs électrons.
Un ion est un atome, qui à perdu ou gagné un ou plusieurs électrons. Exemple, le lithium (Li) perd un électron il devient l'ion de lithium (Li+). Un autre exemple, le fluor (F) gagne un électron, il devient l'ion de fluor (F-). Si un atome perd 2 électrons, imaginons que cette atome soit l'hydrogène (H), il devient l'ion d'hydrogène (H +2 ).
Parmi les ions, on retrouve deux catégorie : les anions et les cations. Nous allons maintenant voir en détails leurs différences.

Comment trouver un cour de physique chimie ?
Les anions
L'anion est un ion qui a gagné des électrons et dont la charge est maintenant négative.
Lors d'une électrolyse, les anions se dirigent naturellement vers l'anode, en raison de leur charge.
Lorsqu'un atome gagne juste deux électrons et possède donc deux charges négations, on l'appelle dianion.
Ce tableau regroupe quelques anions que vous pouvez rencontrer régulièrement :
| Anions | Formules |
|---|---|
| Ion hydroxyde | OH - |
| Ion nitrate | NO3 - |
| Ion fluorure | F - |
| Ion iodure | I - |
| Ion bromure | Br - |
| Ion chlorure | Cl - |
| Ion sulfate | SO4 2- |
| Ion hydrogénosulfate | HSO4 - |
| Ion dichromate | Cr2O7 2- |
| Ion sulfite | SO3 2- |
| Ion hydrogénosulfite | HSO3 2- |
| Ion carbonate | CO3 2- |
| Ion hydrogénocarbonate | HCO3 - |
| Ion phosphate | PO4 3- |
| Ion hydrogénophosphate | HPO4 2- |
| Ion dihydrogénophosphate | H2PO4 - |
| Ion cyanure | CN - |
| Ion nitrite | NO2 - |
| Ion carboxylate | R-COO - |
| Ion permanganate | MnO4 - |
| Ion manganate | MnO4 2- |
| Ion sulfure | S 2- |
| Ion hydrogénosulfure | HS - |
| Ion thiosulfate | S2O3 2- |
| Ion peroxodisulfate | S2O8 2- |
| Ion tetrathionate | S4O6 2- |
| Ion bromate | BrO3 - |
| Ion chromate | CrO4 2- |
| Ion iodate | IO3 - |
| Ion hypochlorite | ClO - |
| Ion chlorite | ClO2 - |
| Ion chlorate | ClO3 - |
| Ion perchlorate | ClO4 - |
| Ion oxalate | -OOC-COO - |
Les cations
Le cation, à l'inverse de l'anion est un atome qui a perdu des électrons et qui a donc une charge positive.
Lors d'une électrolyse, les cations se dirigent naturellement vers la cathode, en raison de leur charge.
Voici un tableau qui récapitule les cations les plus fréquents :
| Cations | Formules |
|---|---|
| Ions oxonium | H3O+ |
| Cuivre I | Cu+ |
| Cuivre II | Cu2+ |
| Ion sodium | Na+ |
| Ion calcium | Ca2+ |
| Fer II | Fe2+ |
| Fer III | Fe3+ |
| Ion lithium | Li+ |
| Ion argent | Ag+ |
| Ion baryum | Ba2+ |
| Ion beryllium | Be2+ |
| Ion magnésium | Mg2+ |
| Ion potassium | K+ |
| Ion plomb | Pb2+ |
| Ion ammonium | NH4+ |
| Ion zinc | Zn2+ |
| Ion diamine argent | Ag(NH3)2+ |
| Ion manganèse II | Mn2+ |
| Ion aluminium | Al3+ |
| Ion chrome | Cr3+ |
| Ion cadmium | Cd2+ |
| Ion cobalt II | Co2+ |
| Ion étain II | Sn2+ |
| Ion étain IV | Sn4+ |
| Ion or | Au3+ |
Quelques exercices
Afin de vous aider à prendre conscience des ions, de leur utilité en chimie et de leur intégration dans notre vie quotidienne, vous trouverez ici quelques exercices de type BAC.
Exercice 1 : Les ions dans l'eau minérale
Les eaux minérales contiennent des espèces dissoutes. La législation impose un étiquetage précisant les quantités contenues dans un litre d’eau.
Sur l’étiquette endommagée d’une bouteille d’eau minérale gazeuse, on peut lire les valeurs des concentrations massiques en ions données dans le tableau ci-dessous.

Les valeurs concernant les ions chlorure et calcium ne sont plus lisibles.
| Cation | Sodium | Potassium | Calcium | Magnésium |
|---|---|---|---|---|
| Formule | Na+ | K+ | Ca2+ | Mg2+ |
| Concentration massique en mg.L-1 | 1708 | 132 | ? | 11 |
| Anion | Hydrogénocarbonate | Chlorure | Sulfate | Fluorure |
|---|---|---|---|---|
| Formule | HCO3- | Cl- | SO42- | F- |
| Concentration massique en mg.L-1 | 4368 | ? | 174 | 1 |
Cet exercice propose, en deux parties, deux méthodes de titrage pour retrouver les valeurs
manquantes :
- Un titrage par précipitation pour déterminer la concentration massique en ions chlorure Cl – ;
- Un titrage complexométrique pour déterminer la concentration massique en ions calcium Ca2+.
1.Première partie : titrage par précipitation des ions chlorure
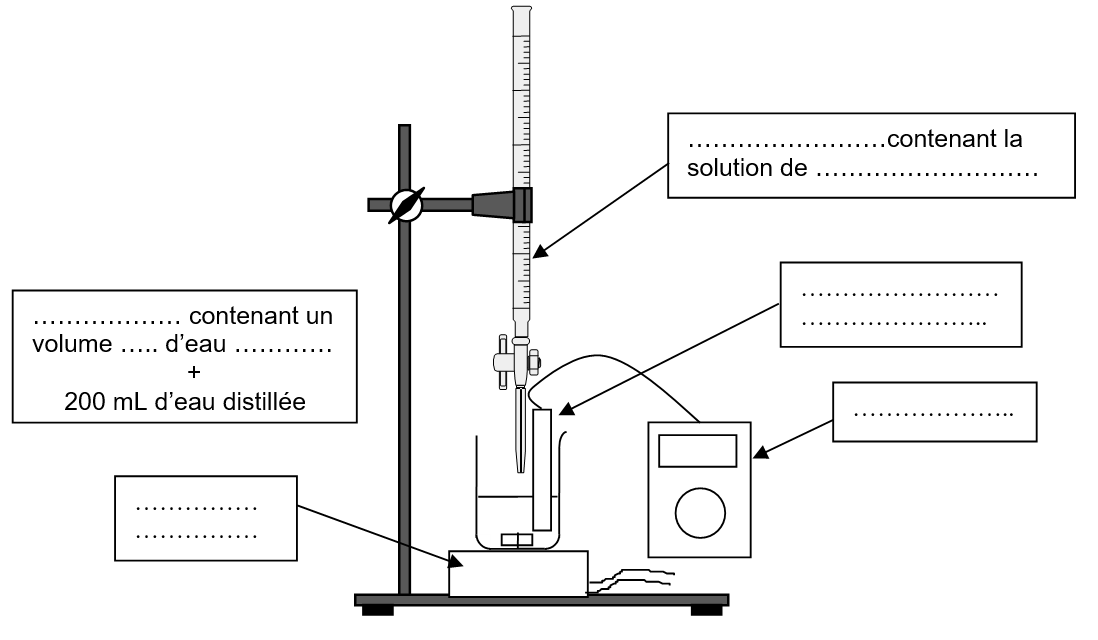
On dégaze l’eau minérale par agitation et on prélève un volume V1 = 20,0 mL que l’on introduit dans un grand becher. On rajoute un volume d’environ 200 mL d’eau distillée. On plonge dans le milieu une cellule de conductimétrie. À l’aide d’une burette graduée, on ajoute progressivement une solution aqueuse de nitrate d’argent (Ag+(aq) + NO3–(aq)) de concentration molaire c2 = 2,00´10 –2 mol.L-1.
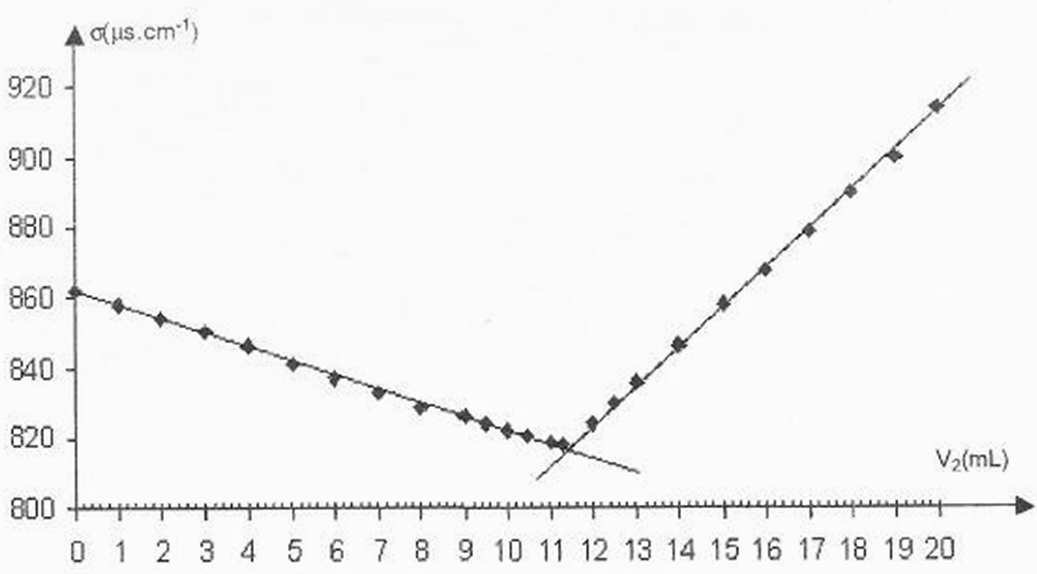
Le mélange obtenu dans le becher est maintenu sous une agitation régulière La figure 1 de l’annexe (à rendre avec la copie) donne la courbe d’évolution de la conductivité s du mélange en fonction du volume V2 versé de la solution de nitrate d’argent.
1.1.Compléter le schéma de la figure 2 de l’annexe (à rendre avec la copie) du dispositif utilisé lors de ce titrage.
1.2.Lors de ce titrage, les ions chlorure Cl –(aq) réagissent avec les ions argent Ag+(aq) pour former un précipité blanc de chlorure d’argent AgCI(s). La transformation associée à la réaction est totale. L’équation de la réaction de précipitation est la suivante :
- Ag+(aq) + Cl –(aq) = AgCI(s)
1.2.1. Ce titrage est-il direct ou indirect ?
1.2.2. Compléter le tableau d'avancement décrivant l’évolution du système à l’équivalence. On note n2Eq la quantité de matière (en mol) d’ions argent versée à l’équivalence.
1.2.3. En déduire !a relation entre la quantité initiale n1 en mol des ions chlorure et la quantité de matière n2éq (en mol) d’ions argent versée à l’équivalence.
1.3.Quel événement correspond au point d’intersection des deux segments de droite de la courbe de la figure 2 de l’annexe ? En déduire la valeur du volume V2éq de la solution de nitrate d’argent versé à l’équivalence.
1.4.En utilisant les questions précédentes, calculer la concentration molaire c1 des ions chlorure dans l’eau minérale étudiée.
1.5.La concentration massique t (exprimée en g.L-1) d’une espèce chimique X en solution est le produit de sa concentration molaire (exprimée en mol.L-1) par sa masse molaire moléculaire (exprimée en g.mol-1).
Calculer la concentration massique notée t1 des ions chlorure dans cette eau minérale. On donnera le résultat en mg.L-1.
Donnée : masse molaire atomique du chlore M(Cl) = 35,5 g.mol-1.
2.Deuxième partie : titrage complexométrique des ions calcium
On utilise comme solution titrante, une solution d’acide ÉthylèneDiamineTétraAcétique connue aussi sous le nom d’EDTA. Ce titrage se fait en présence d’un indicateur coloré de fin de réaction et d’une solution tampon permettant de maintenir le pH de la solution entre 9 et 10.
On réalise le titrage d’un volume V’1 = 20,0 mL d’eau minérale par la solution d’EDTA de concentration molaire c’2 = 5,0x10–3 mol.L-1. À l’équivalence, le volume versé d’EDTA est V’2Eq = 10,8 mL.
2.1.En milieu basique, l’EDTA contient des ions notés Y4–qui réagissent avec les ions calcium (Ca2+) et magnésium (Mg2+) contenus dans l’eau minérale pour former des complexes très stables selon les équations :
- Ca2+ (aq) + Y4–(aq) = [CaY]2– (aq) ;
- Mg2+ (aq) + Y4–(aq) = [MgY]2– (aq).
Soient ni(Ca2+) et ni(Mg2+) les quantités de matière initiales d’ions calcium et magnésium présents dans le volume V1 d’eau minérale, n’2Éq désigne la quantité de matière d’ions Y4- versée pour atteindre l’équivalence.
Quelle relation lie ces trois quantités de matière ?
2.2.Montrer que la somme des concentrations molaires des ions calcium et magnésium est donnée par la relation : 
2.3.À l’aide de la valeur (donnée dans le tableau de l’introduction) de la concentration massique
des ions magnésium contenus dans l’eau minérale étudiée, en déduire la valeur de la concentration massique (en mg.L-1) des ions calcium dans cette eau.
Données :
Masses molaires atomiques
- M(Ca) = 40,1 g.mol-1
- M(Mg) = 24,3 g.mol-1
Annexes
Exercice 2 : Les ions dans la mer
L’Artémia est le nom scientifique d’un petit crustacé qui possède la particularité de pouvoir vivre dans des milieux très salés tels que certains lacs et marais salants. Pour se développer les Artémia ont besoin de vivre dans un milieu marin dont la teneur (ou la concentration massique) moyenne en ions chlorure Cl– est supérieure à 30 g.L-1. Dans ces conditions, leur développement n’est pas compromis car les prédateurs aquatiques ne supportent pas des conditions salines aussi élevées.
Avant d’implanter un élevage d’Artémia dans des marais salants du Sud de la France, on se propose de déterminer la concentration en ions chlorure d’un prélèvement d’eau d’un marais de la zone choisie. Cette eau contient exclusivement des ions sodium et des ions chlorure.
La méthode utilisée permet de doser les ions chlorure par précipitation avec les ions argent Ag+. La réaction de précipitation Ag+(aq) + Cl–(aq) = AgCl(s) peut être considérée comme totale (taux d’avancement t quasiment égal à 1). Le chlorure d’argent formé est un solide blanc.
L’équivalence du dosage sera déterminé de deux manières :
- En utilisant un indicateur coloré ;
- En mesurant la conductivité lors du dosage.

Partie A : dosage colorimétrique
L’indicateur coloré de fin de réaction est préparé en dissolvant quelques grains de dichlorofluorescéine dans un mélange eau-éthanol (méthode de Fajans). La solution obtenue a une couleur jaune. La présence d’ions sodium Na+, chlorure Cl– ou nitrate (NO3–) ne modifie pas la couleur de la dichlorofluorescéine. Par contre, en présence d’ions
Ag+, la solution de dichlorofluorescéine prend une couleur rose-rouge.
1.Illustration du fonctionnement de l’indicateur coloré
On prépare deux tubes à essais, numérotés 1 et 2. Dans chaque tube, on mélange 2,0 mL de solution de chlorure de sodium (Na+(aq) + Cl–(aq)) de concentration 0,10 mol.L-1 et quelques gouttes de solution de l’indicateur coloré préparé avec la dichlorofluorescéine.
- Dans le tube n°1, on ajoute 0,5 mL de solution de nitrate d’argent (Ag+(aq) + NO3–(aq)) de concentration 0,10 mol.L-1 ;
- Dans le tube n°2, on ajoute 2,2 mL de solution de nitrate d’argent de concentration 0,10 mol.L-1.
Quel est le réactif en excès dans chacun des tubes ? Justifier.
Quel est l’aspect et la coloration du contenu de chaque tube ?
2.Principe du dosage
On veut doser un volume V1d’une solution S1 d’ions chlorure par une solution S2 de nitrate d’argent de concentration C2.
Faire un schéma annoté du dispositif de titrage.
Définir l’équivalence et expliquer brièvement comment la déterminer.
3.Préparation de la solution à doser
En septembre 2003, après un été caniculaire, on a prélevé un échantillon d’eau dans un marais salant, de la zone prévue pour implanter l’élevage d’Artémia.
On dilue 10 fois cette eau pour obtenir la solution S1 à doser.
On souhaite obtenir 50 mL de la solution S1. Quel volume d’eau doit-on prélever ?
Désigner et nommer la verrerie à utiliser pour effectuer cette dilution.
Expliquer brièvement le mode opératoire.
4.Exploitation du dosage
On réalise le dosage d’un volume V1 = 10,0 mL de solution S1 par une solution S2 de nitrate d’argent de concentration C2 = 1,00 x 10 –1 mol.L-1. Le volume de nitrate d’argent versé à l’équivalence est : VE = 15,2 mL.
1.Déterminer la concentration molaire des ions chlorure dans la solution S1.
2.En déduire la concentration molaire des ions chlorure dans l’eau du marais.
3.Cette eau est-elle favorable au développement des Artémia ?
Donnée : masse molaire atomique du chlorure : M(Cl) = 35,5 g.mol-1.
Partie B : dosage conductimétrique
Données :
Conductivité molaire ionique à 25°C :
- l(Cl–) = 7,63 x 10-3 S.m2.mol-1 ;
- l(Ag+) = 6,19 x 10-3 S.m2.mol-1 ;
- l(NO3–) = 7,14 x 10-3 S.m2.mol-1 ;
- l(Na+) = 5,01 x 10-3 S.m2.mol-1.
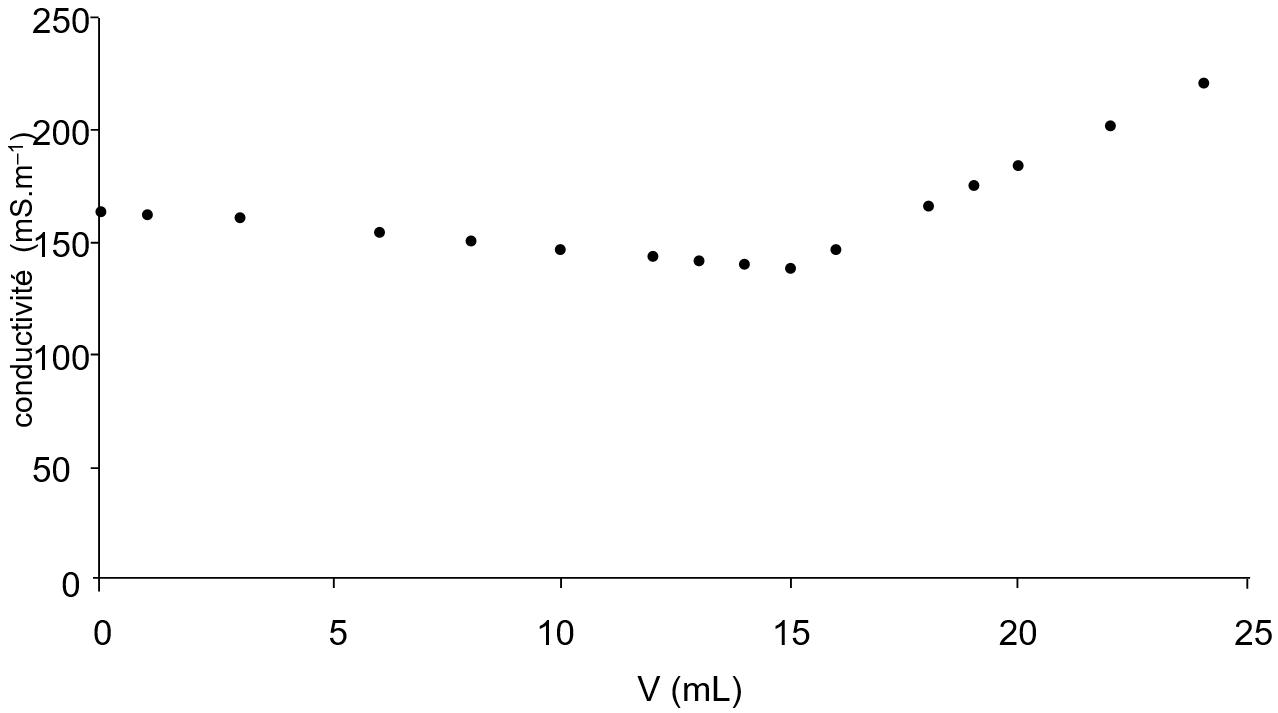
On a reporté en annexe (à rendre avec la copie), l’évolution de la conductivité s au cours du dosage en fonction du volume de nitrate d’argent versé.
1.Déterminer graphiquement sur l’annexe le point d’équivalence E du dosage.
2.Justifier, sans calculs, la diminution de la conductivité avant l’équivalence.
3.Justifier, sans calculs, l’augmentation de la conductivité après l’équivalence.
Annexes























Si vous désirez une aide personnalisée, contactez dès maintenant l’un de nos professeurs !
Un professeur qui rédige un tel article destinée à
des élèves devrait impérativement prêter une nette attention à l orthographe qui est particulièrement déplorable, même pas digne d un niveau collège.
très intéressent
bonjour a tous pourquoi on ne voit pas l’argon
Bonjour,
L’argon ne se voit pas puisqu’il s’agit d’un gaz invisible et incolore.
Comme de nombreux gaz, il est invisible du fait de son état gazeux.
Bonne journée
bonjour avez vous un moyen mnemotechnique pour retenir anion=negatif ou cation =positif ,,?
bien cordialement
joel
Bonjour ! Pourquoi ne pas vous que “anion” commence par la lettre A, et qu’il n’y a un A que dans “négatif”, et pas dans “positif” ? Ainsi, un anion sera forcément négatif !
Bonne journée !